题目内容
(2013?广州三模)根据Mg与CO2的反应推测,Na也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种.某兴趣小组用如下装置开实验探究.
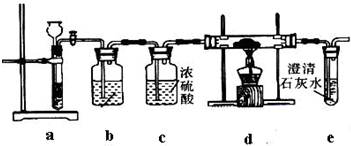
实验I:操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应.停止加热,继续通气体使双通管冷却.
(1)装置b中装有
(2)步骤②中,当观察到
实验Ⅱ:探究反应产物及反应机理.取反应后双通管中固体物质29.2g进行如下实验:
①将固体溶于足量的水并过滤、洗涤,得到1.8g滤渣(干燥);
②将滤液加水稀释配成250mL的溶液;
③取25.00ml步骤②的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,
称量得固体质量为3.94g.
④另取25.00mL步骤②的溶液,滴加甲基橙作为指示剂,用3.0mol?L-1盐酸滴定,消耗盐酸体积为20.00mL.
(3)步骤②中固体溶于水后过滤,不溶物必须经过洗涤,洗涤的具体操作是
(4)通过实验数据分析29.2g残留固体中,含有哪几种固体?
(5)该探究条件下,钠与二氧化碳反应的化学方程式为

实验I:操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应.停止加热,继续通气体使双通管冷却.
(1)装置b中装有
饱和NaHCO3
饱和NaHCO3
溶液.(2)步骤②中,当观察到
e装置中产生白色沉淀
e装置中产生白色沉淀
时,才能进入步骤③.实验Ⅱ:探究反应产物及反应机理.取反应后双通管中固体物质29.2g进行如下实验:
①将固体溶于足量的水并过滤、洗涤,得到1.8g滤渣(干燥);
②将滤液加水稀释配成250mL的溶液;
③取25.00ml步骤②的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,
称量得固体质量为3.94g.
④另取25.00mL步骤②的溶液,滴加甲基橙作为指示剂,用3.0mol?L-1盐酸滴定,消耗盐酸体积为20.00mL.
(3)步骤②中固体溶于水后过滤,不溶物必须经过洗涤,洗涤的具体操作是
将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次
将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次
.(4)通过实验数据分析29.2g残留固体中,含有哪几种固体?
C、Na2O和Na2CO3
C、Na2O和Na2CO3
.其中Na2CO3
Na2CO3
固体最大,为21.2
21.2
g(5)该探究条件下,钠与二氧化碳反应的化学方程式为
12Na+7CO2
3C+2Na2O+4Na2CO3
| ||
12Na+7CO2
3C+2Na2O+4Na2CO3
.
| ||
分析:(1)(2)由实验方案图可知,a为二氧化碳发生装置,d为二氧化碳与钠反应装置,加入d装置的二氧化碳应干燥,没有其其它,故装置b是除去二氧化碳其它中的HCl,应用饱和的碳酸氢钠溶液,c为干燥装置,吸收水蒸气.反应需要排尽装置内的空气,当e装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应;
(3)不溶物表面附着杂质,应进行洗涤,具体操作为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次;
(4)步骤①将固中得到1.8g滤渣(干燥)为不溶物碳.步骤③中最终所得固体质量为3.94g为碳酸钡,说明反应生成碳酸钠,根据碳元素守恒计算生成碳酸钠的质量.步骤④中盐酸滴定碳酸钠,可能发生与氢氧化钠的反应,根据碳酸钠计算消耗的HCl,再根据滴定消耗的总的HCl,判断是否有盐酸与氢氧化钠反应,据此计算解答;
(5)根据(4)中的计算可知反应产物,计算生成物的物质的量关系,据此书写方程式.
(3)不溶物表面附着杂质,应进行洗涤,具体操作为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次;
(4)步骤①将固中得到1.8g滤渣(干燥)为不溶物碳.步骤③中最终所得固体质量为3.94g为碳酸钡,说明反应生成碳酸钠,根据碳元素守恒计算生成碳酸钠的质量.步骤④中盐酸滴定碳酸钠,可能发生与氢氧化钠的反应,根据碳酸钠计算消耗的HCl,再根据滴定消耗的总的HCl,判断是否有盐酸与氢氧化钠反应,据此计算解答;
(5)根据(4)中的计算可知反应产物,计算生成物的物质的量关系,据此书写方程式.
解答:解:(1)由实验方案图可知,a为二氧化碳发生装置,d为二氧化碳与钠反应装置,加入d装置的二氧化碳应干燥,没有其其它,故装置b是除去二氧化碳其它中的HCl,应用饱和的碳酸氢钠溶液,c为干燥装置,吸收水蒸气.反应需要排尽装置内的空气,当e装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应,
故答案为:饱和NaHCO3;
(2)由(1)的分析可知,反应需要排尽装置内的空气,当e装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应,
故答案为:e装置中产生白色沉淀;
(3)不溶物表面附着杂质,应进行洗涤,具体操作为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次,
故答案为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次;
(4)步骤①将固中得到1.8g滤渣(干燥)为不溶物碳.
步骤③中最终所得固体质量为3.94g为碳酸钡,说明反应生成碳酸钠,根据碳元素守恒可知,碳酸钠的物质的量=
=0.02mol,故29.2g固体物质中碳酸钠的物质的量为0.02mol×
=0.2mol,其质量=0.2mol×106g/mol=21.2g.
步骤④中盐酸滴定碳酸钠,消耗盐酸的物质的量为0.02mol×2=0.04mol,实际消耗HCl为3.0mol?L-1×0.020L=0.06mol,大于0.02mol,故溶液中含有氢氧化钠,说明反应中有氧化钠生成,滴定中氢氧化钠消耗的HCl为0.06mol-0.04mol=0.02mol,根据钠离子守恒可知氧化钠的物质的量为
=0.01mol,故29.2g固体物质中氧化钠的物质的量为0.01mol×
=0.1mol,其质量为0.1mol×62g/mol=6.2g,且1.8g+21.2g+6.2g=29.2g,等于所取固体物质的质量,故生成为C、Na2O和Na2CO3,且固体物质中碳酸钠的质量最大,
故答案为:C、Na2O和Na2CO3; Na2CO3;21.2;
(5)根据(4)中的计算可知产物为C、Na2O和Na2CO3,三者物质的量之比为
:0.1mol:0.2mol=3:2:4,故反应方程式为:12Na+7CO2
3C+2Na2O+4Na2CO3,
故答案为:12Na+7CO2
3C+2Na2O+4Na2CO3.
故答案为:饱和NaHCO3;
(2)由(1)的分析可知,反应需要排尽装置内的空气,当e装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应,
故答案为:e装置中产生白色沉淀;
(3)不溶物表面附着杂质,应进行洗涤,具体操作为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次,
故答案为:将蒸馏水沿玻璃棒注入纸漏斗中,至刚好浸没沉淀,静置待水滤出,重复上述操作2~3次;
(4)步骤①将固中得到1.8g滤渣(干燥)为不溶物碳.
步骤③中最终所得固体质量为3.94g为碳酸钡,说明反应生成碳酸钠,根据碳元素守恒可知,碳酸钠的物质的量=
| 3.94g |
| 197g/mol |
| 250mL |
| 25mL |
步骤④中盐酸滴定碳酸钠,消耗盐酸的物质的量为0.02mol×2=0.04mol,实际消耗HCl为3.0mol?L-1×0.020L=0.06mol,大于0.02mol,故溶液中含有氢氧化钠,说明反应中有氧化钠生成,滴定中氢氧化钠消耗的HCl为0.06mol-0.04mol=0.02mol,根据钠离子守恒可知氧化钠的物质的量为
| 0.02mol |
| 2 |
| 250mL |
| 25mL |
故答案为:C、Na2O和Na2CO3; Na2CO3;21.2;
(5)根据(4)中的计算可知产物为C、Na2O和Na2CO3,三者物质的量之比为
| 1.8g |
| 12g/mol |
| ||
故答案为:12Na+7CO2
| ||
点评:本题考查物质组成与探究,涉及对实验方案的理解、实验基本操作、化学计算与数据处理等,确定生成物的成分以发生的反应是难度,也是易错点,注意不能直接利用固体物质质量减去碳与碳酸钠的质量确定氧化钠的质量,题目难度较大.

练习册系列答案
相关题目

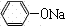 +CO2+H2O→
+CO2+H2O→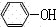 +NaHCO3
+NaHCO3