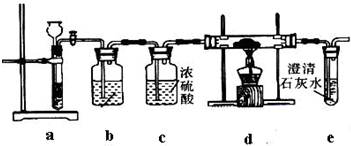
题目内容
(2013?广州三模)某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃.沸点:乙酸118℃、苯酚182℃.
(1)写出②的反应化学方程式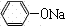 +CO2+H2O→
+CO2+H2O→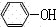 +NaHCO3
+NaHCO3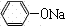 +CO2+H2O→
+CO2+H2O→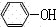 +NaHCO3
+NaHCO3
(2)②中分离B的操作名称是
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释.
限选试剂:蒸馏水、稀HN03、2moL?L-1 NaOH、0.1mol-L-1 KSCN、酸性KMn04溶液、FeCl3溶液、饱和溴水、紫色石蕊试液.
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容.取此溶液25.00mL,加入浓度为0.0500moL?L-1的溴水溶液30mL,放置.待反应完全后,加入过量的KI,再用0.1100moL-L-1,Na2S203标准溶液滴定生成的I2,耗去Na2S203标准溶液11.80mL.则试样中C物质的量的计算表达式 为:
(部分反应离子方程式:I2+2S2O
=2I-+S4O
)

己知熔点:乙酸16.6℃、苯酚43℃.沸点:乙酸118℃、苯酚182℃.
(1)写出②的反应化学方程式
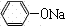 +CO2+H2O→
+CO2+H2O→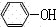 +NaHCO3
+NaHCO3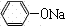 +CO2+H2O→
+CO2+H2O→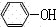 +NaHCO3
+NaHCO3(2)②中分离B的操作名称是
分液
分液
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释.
限选试剂:蒸馏水、稀HN03、2moL?L-1 NaOH、0.1mol-L-1 KSCN、酸性KMn04溶液、FeCl3溶液、饱和溴水、紫色石蕊试液.
|
(0.0500mol/Lx30.00x10-3L-1/2x0.1100mol/Lx11.80x10-3L)x1/3x40
(0.0500mol/Lx30.00x10-3L-1/2x0.1100mol/Lx11.80x10-3L)x1/3x40
.(部分反应离子方程式:I2+2S2O
2- 3 |
2- 6 |
分析:(1)苯酚钠溶液通入过量二氧化碳,生成苯酚和碳酸氢钠;
(2)②苯酚在冷水中的溶解度较小,乙酸钠易溶于水;
(3)根据苯酚的溶解性和苯酚和溴水的取代反应解答;
(4)根据溴的氧化性氧化溴离子结合溴与苯酚反应和I2+2S2O32-=2I-+S4O62-进行解答;
(2)②苯酚在冷水中的溶解度较小,乙酸钠易溶于水;
(3)根据苯酚的溶解性和苯酚和溴水的取代反应解答;
(4)根据溴的氧化性氧化溴离子结合溴与苯酚反应和I2+2S2O32-=2I-+S4O62-进行解答;
解答:解:
(1)依据碳酸性比苯酚的酸性强,弱酸盐与“强”酸发生的复分解反应,二氧化碳和苯酚钠反应生成苯酚,反应的方程式为: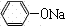 +CO2+H2O→
+CO2+H2O→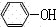 +NaHCO3,
+NaHCO3,
故答案为: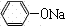 +CO2+H2O→
+CO2+H2O→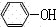 +NaHCO3;
+NaHCO3;
(2)加氢氧化钠溶液,氢氧化钠和苯酚反应生成溶于水的苯酚钠,乙酸和氢氧化钠反应生成乙酸钠;
苯酚钠和乙酸钠溶液通过二氧化碳,苯酚钠和二氧化碳、水反应生成碳酸氢钠和苯酚,而乙酸钠和二氧化碳不反应,苯酚在冷水中的溶解度较小,乙酸钠易溶于水,所以用分液的方法进行分离;
故答案为:分液;
(3)步骤1取少量苯酚放入a试管,加入少量蒸馏水,振荡,苯酚为有机物,在常温下在水中的溶解度不大,所以出现白色浑浊,步骤2:苯酚与溴发生取代反应,生成三溴苯酚白色沉淀,所以出现产生白色沉淀,苯酚和三氯化铁作用,形成络合物,呈现紫色,
故答案为:
(4)称取一定量的苯酚试样,用水溶解后全部转移至1000mL容量瓶中定容.取此溶液25.00mL,苯酚物质的量为原溶液的
,加入浓度为0.0500moL?L-1的溴水溶液30mL,苯酚与溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代反应的化学方程式为: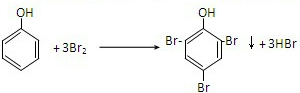 ,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为
,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为
x 0.1100 mol/L x 11.80 x 10-3L,所以试样中C物质的量:(0.0500mol/L x 30.00 x 10-3L-
x 0.1100 mol/L x 11.80 x 10-3L)x
x 40;
故答案为:(0.0500mol/L x 30.00 x 10-3L-
x 0.1100 mol/L x 11.80 x 10-3L)x
x 40;
(1)依据碳酸性比苯酚的酸性强,弱酸盐与“强”酸发生的复分解反应,二氧化碳和苯酚钠反应生成苯酚,反应的方程式为:
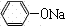 +CO2+H2O→
+CO2+H2O→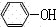 +NaHCO3,
+NaHCO3,故答案为:
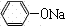 +CO2+H2O→
+CO2+H2O→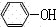 +NaHCO3;
+NaHCO3;(2)加氢氧化钠溶液,氢氧化钠和苯酚反应生成溶于水的苯酚钠,乙酸和氢氧化钠反应生成乙酸钠;
苯酚钠和乙酸钠溶液通过二氧化碳,苯酚钠和二氧化碳、水反应生成碳酸氢钠和苯酚,而乙酸钠和二氧化碳不反应,苯酚在冷水中的溶解度较小,乙酸钠易溶于水,所以用分液的方法进行分离;
故答案为:分液;
(3)步骤1取少量苯酚放入a试管,加入少量蒸馏水,振荡,苯酚为有机物,在常温下在水中的溶解度不大,所以出现白色浑浊,步骤2:苯酚与溴发生取代反应,生成三溴苯酚白色沉淀,所以出现产生白色沉淀,苯酚和三氯化铁作用,形成络合物,呈现紫色,
故答案为:
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡. | 出现白色浑浊 |
苯酚常温下溶解度不大 |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管滴入过量饱和溴水,振荡. | 产生白色沉淀 |
苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. |
| 步骤3:往c试管滴入几滴FeCl3溶液,振荡. | 溶液变为紫色 | C与加入的试剂发生显色反应. |
| 1 |
| 40 |
 ,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为
,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 3 |
故答案为:(0.0500mol/L x 30.00 x 10-3L-
| 1 |
| 2 |
| 1 |
| 3 |
点评:本题考查了苯酚的性质,根据苯和苯酚的性质区别以及苯的溶解性和苯的取代反应进行解答,难度较大.

练习册系列答案
相关题目