题目内容
6.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)△H=-2878kJ•mol-1(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);△H=-2869kJ•mol-1
下列说法正确的是( )
| A. | 正丁烷分子储存的能量大于异丁烷分子 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
分析 A、根据化学反应中能量守恒,放出的热量=反应物的总能量-生成物的总能量;
B、根据物质具有的能量越低越稳定来判断;
C、根据异丁烷转化为正丁烷的能量高低来判断;
D、根据正丁烷和异丁烷中含有的化学键来回答.
解答 解:A、因化学反应中能量守恒,放出的热量=反应物的总能量-生成物的总能量,生成物的总能量的能量相同时,放出的热量越多,反应物的总能量越多,故A正确;
B、物质具有的能量越低越稳定,根据A可知正丁烷分子储存的能量大于异丁烷分子,所以正丁烷的稳定性小于异丁烷,故B错误;
C、因正丁烷的能量比异丁烷的能量高,所以异丁烷转化为正丁烷的过程是一个吸热过程,故C错误;
D、在正丁烷和异丁烷中,均含有碳碳单键和碳氢单键,数目一样多,故D错误;故选A.
点评 本题主要考查了化学反应中能量守恒和化学键的判断知识,难度不大,可根据课本知识完成.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
16.在“部分酸碱盐溶解性表”中存在“碳酸亚铁”.某学习小组设计实验探究碳酸亚铁的性质.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
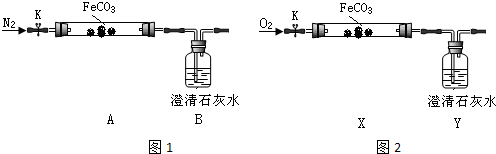
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
【实验评价】③上述实验i(填:i或ii)不能确定样品成分.
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)

连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
1.在指定环境中,下列各组离子一定能够大量共存的是( )
| A. | 在pH=1的无色溶液中:SO42-、Cu2+、Na+、Cl- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、SO42- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ |
11.对于反应A2+3B2═2C+D,化学反应速率最快的是( )
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |
18.下列变化中,属于化学变化的是( )
| A. | 石油分馏 | B. | 碘片升华 | C. | 食盐熔化 | D. | 煤的干馏 |
15.下列俗名和化学式配对错误的是 ( )
| A. | 明矾→KAlSO4•12H2O | B. | 重晶石→BaSO4 | ||
| C. | 熟石膏→2CaSO4•H2O | D. | 硫磺→S |
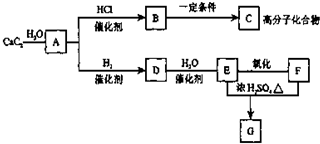 根据如图,回答问题.
根据如图,回答问题. ,GCH3COOCH2CH3
,GCH3COOCH2CH3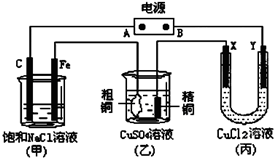 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色.试回答下列问题: