题目内容
如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
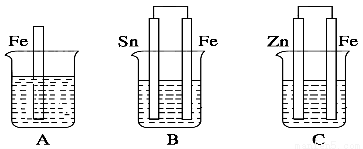
(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________。
(3)C中被腐蚀的金属是________,总反应的化学方程式为_____________________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________。
(填序号)。
(1)Fe+2H+=Fe2++H2↑
(2)2H++2e-=H2↑
(3)Zn Zn+H2SO4=ZnSO4+H2↑ B>A>C
【解析】A中铁与稀H2SO4反应;B中形成Sn-H2SO4-Fe原电池,其中Fe作负极,Sn作正极,负极的电极反应是Fe—2e-=Fe2+,正极的电极反应是2H++2e-=H2↑;C中形成Zn-H2SO4-Fe原电池,Zn作负极被腐蚀,总反应方程式为Zn+H2SO4=ZnSO4+H2↑。比较A、B、C三种情况可知:B中Fe作负极,被腐蚀得最快,C中的Fe作正极,被腐蚀得最慢。

练习册系列答案
相关题目