题目内容
【题目】将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去200.0 mL。将所得的沉淀灼烧、冷却后称量得固体质量为4.40 g。
(1)求上述硫酸的物质的量浓度c(H2SO4)=____________________________。
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=______________。
【答案】4.00 mol·L-1 1:10
【解析】
将含氧化镁的镁条完全溶于硫酸溶液后,发生反应MgO+H2SO4=MgSO4+H2O,Mg+H2SO4=MgSO4+H2↑,滴加2.00mo1/L氢氧化钠液,恰好完全沉淀时用去200.0mL,发生反应MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,将所得的沉淀灼烧、冷却后称量得固体质量为4.40 g,发生反应Mg(OH)2![]() MgO+ H2O,结合反应方程式和原子守恒分析解答。
MgO+ H2O,结合反应方程式和原子守恒分析解答。
(1)将2.80g含氧化镁的镁条完全溶于50.0mL硫酸溶液后,滴加2.00mo1/L氢氧化钠液,恰好完全沉淀时用去200.0mL.可知完全沉淀后,溶液为Na2SO4溶液,根据原子守恒可知,n(SO42-)= ![]() (Na+)=2.0mol/L×0.2L×
(Na+)=2.0mol/L×0.2L×![]() =0.2mol,则硫酸溶液的物质量浓度为
=0.2mol,则硫酸溶液的物质量浓度为![]() =4.00 mol/L,故答案为:4.00 mol/L;
=4.00 mol/L,故答案为:4.00 mol/L;
(2)将所得沉淀灼烧、冷却后称量得固体质量为4.40g,所得固体为MgO,其物质的量为![]() =0.11mol,设Mg的物质的量为x,MgO为y,则x+y=0.11mol,24g/mol×x+40 g/mol×y=4.4g,解得:x=0.1mol,y=0.01mol,则镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=0.01mol∶0.1mol=1∶10,故答案为:1∶10。
=0.11mol,设Mg的物质的量为x,MgO为y,则x+y=0.11mol,24g/mol×x+40 g/mol×y=4.4g,解得:x=0.1mol,y=0.01mol,则镁条中氧化镁和镁的物质的量之比为n(MgO)∶n(Mg)=0.01mol∶0.1mol=1∶10,故答案为:1∶10。

 名校课堂系列答案
名校课堂系列答案【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)氯吡苯脲是一种西瓜膨大剂(植物生长调节剂),其组成结构和物理性质见下表。
分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
C12H10ClN3O |
| 白色结晶粉末 | 170~172 ℃ | 易溶于水 |
查文献可知,可用2-氯-4-氨吡啶与异氰酸苯酯反应,生成氯吡苯脲。
![]()
反应过程中,每生成1 mol氯吡苯脲,断裂____个σ键、断裂____个π键。
(2)过渡金属离子与水分子形成的配合物是否有颜色与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如Co(H2O)6]2+显粉红色。据此判断:Mn(H2O)6]2+_____(填“无”或“有”)颜色。
(3)硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成B(OH)4]-而体现一元弱酸的性质,则B(OH)4]-中B的原子杂化类型为_________;
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:___________________________________。
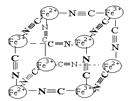
(5)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为____________;其中四核阳离子的立体构型为____________,其中心原子的杂化轨道类型是____________。
②分子中的大π键可用符号表示πmn,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为π66。则N5-中的大π键应表示为____________。
③请表示出上图中的氢键:________________________。
【题目】下列实验操作、理象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向某溶液中加入NaOH 溶液,并用湿润的红色石蕊试纸检验 | 试纸没有变蓝 | 原溶液中没有有NH4+ |
B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
C | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液变红 | 原溶液中一定有Fe2+ |
D | 向某无色溶液中滴加BaCl2溶液 | 产生白色沉淀 | 该无色溶液中一定含有SO42- |
A. A B. B C. C D. D