题目内容
【题目】回答下列问题:
(1)1 mol CO2中含有的σ键数目为________,π键数目为________。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为________。CH2=CHCN分子中σ键与π键数目之比为________。
(3)肼(N2H4)分子可视为NH3分子中的—个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(4)Co 基态原子核外电子排布式为____________;
基态Ge原子的核外电子排布式为____________;
Zn2+的价电子轨道表示式为_______________;
Co3+核外电子未成对电子数为__________________。
(5)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______________________。
【答案】2NA 2NA 1:2 2:1 3 1s22s22p63s23p63d74s2 1s22s22p63s23p63d104s24p2;  4 HF>H2O>NH3>CH4
4 HF>H2O>NH3>CH4
【解析】
(1) CO2的结构式是O=C=O,1个二氧化碳分子中有2个碳氧双键,双键中有1个σ键和1个π键,1 mol CO2中含有的σ键数目为2NA,π键数目为2NA。
(2) N2的结构式是N![]() N,三键中1个σ键和 2个π键,已知CO和CN-与N2结构相似,CO分子内存在C
N,三键中1个σ键和 2个π键,已知CO和CN-与N2结构相似,CO分子内存在C![]() O键,σ键与π键个数之比为1:2。CH2=CHCN分子的结构式是
O键,σ键与π键个数之比为1:2。CH2=CHCN分子的结构式是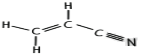 ,分子中有6个σ键和3个π键,σ键与π键数目之比为2:1。
,分子中有6个σ键和3个π键,σ键与π键数目之比为2:1。
(3) N2的结构式是N![]() N,三键中1个σ键和 2个π键,产物中只有N2含有π键;肼(N2H4)分子中含有4个N-H键。燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则消耗1mol N2H4,生成1.5mol N2,形成的π键有3mol。
N,三键中1个σ键和 2个π键,产物中只有N2含有π键;肼(N2H4)分子中含有4个N-H键。燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则消耗1mol N2H4,生成1.5mol N2,形成的π键有3mol。
(4)Co 是27号元素,核外有27个电子,根据能量最低原理,其核外电子排布式为1s22s22p63s23p63d74s2;
Ge是32号元素,基态Ge原子的核外电子排布式为1s22s22p63s23p63d104s24p2;
Zn是30号元素,Zn价电子排布式是3d104s2,Zn2+的价电子排布式是3d10,Zn2+价电子轨道表示式为 ;
;
Co3+核外电子排布式是1s22s22p63s23p63d6,Co3+的价电子排布图是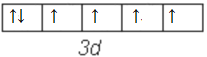 ,Co3+核外电子未成对电子数为4。
,Co3+核外电子未成对电子数为4。
(5)同周期元素从左到右电负性增强,原子吸引电子能力增强,所以CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是HF>H2O>NH3>CH4。

 名校课堂系列答案
名校课堂系列答案【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 元素原子的核外p电子数比s电子数少1 |
C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1; I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D | 原子核外所有p轨道全满或半满 |
E | 元素的主族序数与周期数的差为4 |
F | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有______个伸展方向,原子轨道呈________形。
(2)某同学根据上述信息,推断C基态原子的轨道表示式为![]() 该同学所画的轨道表示式违背了________________。
该同学所画的轨道表示式违背了________________。
(3)G位于______族__________区,价电子排布式为________________。
(4)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因:_____________。
(5)写出E的单质与水反应的离子方程式:_____________________________________
(6)写出DA3的电子式_______________________(用元素符号)