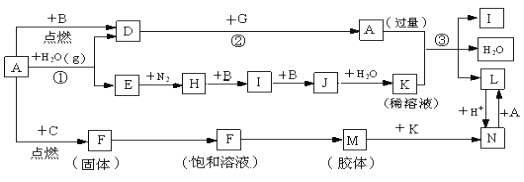
题目内容
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
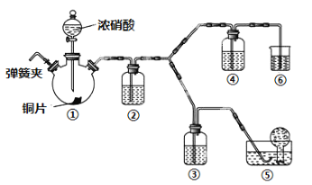
可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。
已知:氢氧化钠溶液不与NO反应,能与NO2反应。2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是____、____、_______。
(2)滴加浓硝酸之前的一系列操作依次是检验装置的气密性,加入药品,打开弹簧夹后______。
(3)装置①中发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是_________。
【答案】稀硝酸 浓硝酸 氢氧化钠溶液 通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
【解析】
验证浓硝酸的氧化性,应首先检查装置的气密性,浓硝酸与铜发生反应生成二氧化氮,通入水后生成一氧化氮,然后分别通过浓硝酸和稀硝酸,如通过浓硝酸无色气体生成红棕色气体,可证明浓硝酸能将NO氧化成NO2,如通过稀硝酸无色气体没有明显变化,则证明稀硝酸不能氧化NO,氮的氧化物不能直接排放到空气中,应有尾气处理装置,据此分析解答。
(1)根据装置特点和实验目的,可以将生成的NO分别通过浓硝酸和稀硝酸,如通过浓硝酸无色气体生成红棕色气体,可证明浓硝酸能将NO氧化成NO2,如通过稀硝酸无色气体没有明显变化,则证明稀硝酸不能氧化NO,氮的氧化物不能直接排放到空气中,应有尾气处理装置,因此装置⑤是收集NO,装置③中应该盛放稀硝酸;装置④中盛放浓硝酸,装置⑥中盛放NaOH溶液吸收NO2防止污染大气,故答案为:稀硝酸;浓硝酸;氢氧化钠溶液;
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出,故答案为:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内;
(3)装置①中Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,NO通过稀HNO3溶液后,无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化;装置④中盛放的是浓HNO3,浓HNO3能氧化NO,则装置④液面的上方会产生红棕色气体,故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色。

 名校课堂系列答案
名校课堂系列答案【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
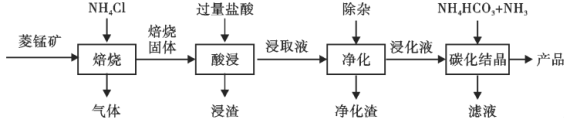
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
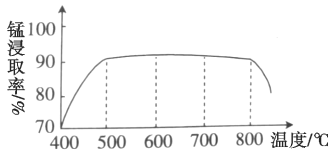
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。