题目内容
【题目】下列说法正确的是
A.反应2CO(g)+O2(g)=2CO2(g)在一定条件下能自发进行的原因是ΔS>0
B.由Ksp[Mg(OH)2]=1.8×10-11可知常温下pH=8的溶液中,c(Mg2+)≤1.8×10-5mol·L1
C.反应H2(g)+Cl2(g)=2HCl(g)的ΔH可用下式换算:ΔH=反应中断裂的旧化学键键能之和-反应中形成的新化学键键能之和
D.由反应C(s)+1/2O2 (g)=CO(g)ΔH=-111 kJ·mol1可知C的燃烧热是111 kJ·mol1
【答案】C
【解析】
A. 反应2CO(g)+O2(g)=2CO2(g)为气体分子数减小的反应ΔS<0,而在一定条件下能自发进行的原因是ΔH<0,A项错误;
B. 常温下pH=8的溶液中,c(OH-)=1×10-6 mol/L,则c(Mg2+)=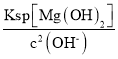 =
=![]() =18 mol/L,B项错误;
=18 mol/L,B项错误;
C. 化学反应中的反应热ΔH=反应中断裂的旧化学键键能之和-反应中形成的新化学键键能之和,C项正确;
D. 燃烧热是指1mol可燃物完全燃烧生成稳定氧化物所放出的热量,C(s)对应的稳定氧化产物为CO2(g),而不是CO(g),D项错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目