题目内容
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)

⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
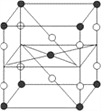
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
【答案】[Ar]3d6 N、O、S S8相对分子质量大,分子间范德华力强 平面三角形 sp3杂化 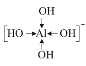 AlN 熔点高,晶体类型为原子晶体 12 HCl为极性分子,极性分子易溶于极性溶剂水中 7NA sp杂化
AlN 熔点高,晶体类型为原子晶体 12 HCl为极性分子,极性分子易溶于极性溶剂水中 7NA sp杂化
【解析】
J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素,J的原子半径是周期表所有元素中最小的,则J为H元素;M基态原子的3个能级所含电子数相同,则M的核外电子排布式为1s22s22p2,推知M为C元素;R的基态原子2p能级上未成对电子数与M相同,为2,则R的核外电子排布式为1s22s22p4,为O元素;根据M、Q、R原子序数依次增大的信息可知,Q为N元素;T的基态原子含13种运动状态不同的电子,则T为Al元素;X与O位于同一主族,为S元素;Y的基态原子最外层有6个电子,原子序数比X大,则推知为Cl元素;Z的基态原子最外层电子数是次外层的1/7,则Z为Fe元素,结合物质的结构与性质分析作答。
根据上述分析可知,J、M、Q、R、T、X、Y、Z分别是H、C、N、O、Al、S、Cl和Fe元素,则
⑴Fe的原子序数为26,其核外电子排布式为[Ar]3d64s2,故基态Fe2+的核外电子排布式是[Ar]3d6;
⑵Q、R、X分别是N、O、S,因同一周期第一电离能呈增大趋势,但N位于第V族,p能级为半充满结构,处于稳定状态,其第一电离能比O的大,而S与O位于同一主族,S的第一电离能比O的小,故第一电离能由大到小的顺序是:N、O、S;
⑶S8和SO2均为分子晶体,但S8的相对分子质量较大,分子间范德华力强,因此熔沸点较SO2高,故答案为:S8相对分子质量大,分子间范德华力强;
⑷气态SO3以单分子形式存在,其价层电子对数=3+![]() =3,故其分子的立体构型为平面三角形;根据图中X的成键方式空间构型为四面体可知,X原子的杂化轨道类型为sp3杂化,故答案为:平面三角形;sp3杂化;
=3,故其分子的立体构型为平面三角形;根据图中X的成键方式空间构型为四面体可知,X原子的杂化轨道类型为sp3杂化,故答案为:平面三角形;sp3杂化;
⑸[Al(OH)4]-中Al3+为中心离子,OH-为配体,O原子提供孤对电子,配位数为4,则其构型可表示为: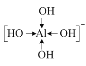 ;
;
⑹根据均摊法可知,晶胞内Al的个数为:![]() =4,N的个数为:4,故该晶体的化学式为AlN;根据题意可知,该晶体为原子晶体,因此熔点较高,故答案为:AlN;熔点高,晶体类型为原子晶体;
=4,N的个数为:4,故该晶体的化学式为AlN;根据题意可知,该晶体为原子晶体,因此熔点较高,故答案为:AlN;熔点高,晶体类型为原子晶体;
⑺根据图中立体结构可知,距离每个Fe2+最近的Fe2+的个数是12,故答案为:12;
⑻HCl为极性分子,水也为极性分子,根据相似相溶原理可知,极性分子易溶于极性溶剂水中,故答案为:HCl为极性分子,极性分子易溶于极性溶剂水中;
⑼CO(NH2)2的结构简式为:NH2-CO-NH2,其中1mol所含σ键的数目是7NA,故答案为:7NA;
⑽CNO-的中心原子C的的价层电子对数=2+![]() =2,其杂化轨道类型为sp杂化。
=2,其杂化轨道类型为sp杂化。