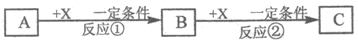
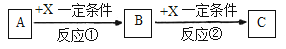题目内容
参照下表几种物质的溶解度,用固体NaOH、水、CaCO3(s)、盐酸为原料制取33 g纯NaHCO3晶体。25 ℃ | 溶解度 |
NaHCO3 | 9 |
Na2CO3 | 33 |
NaOH | 110 |
(1)若用水100 g,则制取时需NaOH________________g。
(2)若用NaOH(s)17.86 g,则需用水_______________________g。
解析:本题应紧紧抓住溶解度的概念进行剖析,要在溶液中制取33 g NaHCO3,不能用加热蒸干溶液的方法得到NaHCO3,因为NaHCO3受热易分解,只能用结晶析出法得到NaHCO3晶体。
(1)25 ℃时,100 g水中溶解NaHCO3 9 g,要析出33 g,则应生成(33+9) g NaHCO3,由反应NaOH+CO2===NaHCO3可知需NaOH 20 g。
(2)设用17.86 g NaOH(s)能得到x g NaHCO3。
NaOH+CO2===NaHCO3
40 84
17.86 x
解得x=37.5 g
要析出33 g NaHCO3,则溶于水的NaHCO3应为37.5 g-33 g=4.5 g。
溶解4.5 g NaHCO3需水:![]() =50 g。
=50 g。
答案:(1)20 (2)50

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目