��Ŀ����
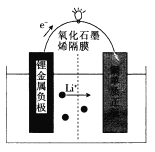
����Ŀ��ijѧ����������װ��̽�������백��֮��ķ�Ӧ������A��F�ֱ�Ϊ�����������ķ���װ�ã�CΪ��������������백����Ӧ��װ�á�

��ش��������⣺
��1��װ��F�з�����Ӧ�����ӷ���ʽ��_________________________________________��
��2��װ��A����ƿ�п�װ�Լ�_______________________________________________��
��3��Bװ�õ�������_______________��Eװ�õ�����_____________________________��
��4��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ����д����Ӧ�Ļ�ѧ����ʽ��_______________��
��5��ͨ��Cװ�õ�����������߽ϳ����ұ߽϶̣�Ŀ����____________________________��
���𰸡�MnO2��4H����2Cl��![]() Mn2����Cl2����2H2O ��ʯ�һ������������ ����� ��ȥ�����е��Ȼ��� 3Cl2��8NH3=N2��6NH4Cl ʹ�ܶȴ���������ܶ�С�İ����Ͽ�ؾ��Ȼ��
Mn2����Cl2����2H2O ��ʯ�һ������������ ����� ��ȥ�����е��Ȼ��� 3Cl2��8NH3=N2��6NH4Cl ʹ�ܶȴ���������ܶ�С�İ����Ͽ�ؾ��Ȼ��
��������
(1)����������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ��
(2)װ��AΪ�Ʊ�������װ�ã����ͼʾ�����жϣ�
(3)����ͼʾ��ϳ�����װ��ʾ��ͼ�����жϣ�Ũ�����ӷ����Ʊ�����������ˮ�������Ȼ��⣬�Ȼ������弫�����ڱ���ʳ��ˮ�е�֪ʶ���ش�
(4)�������������ԣ��백����Ϸ���������ԭ��Ӧ�����������д��Ӧ�ķ���ʽ��
(5)���ݰ������������ܶȴ�С�Լ���֤���߳�ֻ�ϵķ������ش�
(1)װ��F�ж���������Ũ�����ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����Ӧ�����ӷ���ʽ��MnO2+4H++2Cl- ![]() Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl-
Mn2++Cl2��+2H2O���ʴ�Ϊ��MnO2+4H++2Cl- ![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(2)װ��AΪ�Ʊ�������װ�ã�����ͼʾ��Ũ��ˮ��������ʯ�һ���������������÷ų��������ʴ�Ϊ����ʯ�һ�����������ƣ�
(3)����ͼʾ��װ��BΪ����ܣ�Ũ�����ӷ����Ʊ�����������ˮ�������Ȼ��⣬�Ȼ������弫�����ڱ���ʳ��ˮ�У�������Eװ�ÿ��Գ�ȥ�����е��Ȼ��⣬�ʴ�Ϊ������ܣ���ȥ�����е��Ȼ��⣻
(4)�������������ԣ��백����Ϸ���������ԭ��Ӧ��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ�������ɵ������Ȼ�泥���Ӧ�Ļ�ѧ����ʽ��3Cl2+8NH3=N2+6NH4Cl���ʴ�Ϊ��3Cl2+8NH3=N2+6NH4Cl��
(5)�����ܶȱ�������С��ͨ��Cװ�õ�����������߽ϳ�(������)���ұ߽϶�(������)�����Ա�֤���߳�ֻ�ϣ��ʴ�Ϊ��ʹ�ܶȽϴ��Cl2���ܶȽ�С��NH3�Ͽ�ؾ��Ȼ�ϡ�

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�����Ŀ���Ըߴ�H2Ϊȼ�ϵ����ӽ���Ĥȼ�ϵ�ؾ�������Ч�ʸߡ�����Ⱦ���ŵ㣬��ȼ����������CO���������̵��������
(1)�Լ״�Ϊԭ����ȡ�ߴ�H2����Ҫ�о����״�ˮ��������������Ҫ��������������Ӧ��
����Ӧ��CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) ��H = +49 kJmol��1
����Ӧ��H2(g) + CO2(g) ==CO(g) + H2O(g) ��H=+41 kJmol��1
�ټ״������ڴ����������ѽ�ɵõ�H2��CO����÷�Ӧ���Ȼ�ѧ����ʽΪ_________________�����ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ��_________________��
�ڷ����ʵ�����ˮ����![]() �Լ״�ˮ������������ĺô���_______________��
�Լ״�ˮ������������ĺô���_______________��
��ij�¶��£���n(H2O)��n(CH3OH) = 1��1��ԭ������������ܱ������У���ʼѹǿΪP1����Ӧ��ƽ��ʱ��ѹǿΪP2����ƽ��ʱ�״���ת����Ϊ____________�����Ը���Ӧ����
(2)��ҵ����CH4��ˮ������һ����������ȡH2��ԭ��Ϊ��CH4(g) + H2O(g)=CO(g) + 3H2(g) ��H = + 203 kJmol��1
�ٸ÷�Ӧ�淴Ӧ���ʱ���ʽΪ��v��=kc(CO) c3(H2)��k Ϊ���ʳ�������ij�¶��²��ʵ�����������
COŨ��(molL��1) | H2Ũ��(molL��1) | �淴Ӧ����(molL��1min��1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
���������ݿɵø��¶��£��÷�Ӧ���淴Ӧ���ʳ��� kΪ_________L3mol��3min��1��

�������Ϊ3 L���ܱ�������ͨ�����ʵ�����Ϊ3 mol��CH4��ˮ��������һ�������·���������Ӧ�����ƽ��ʱH2������������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ѹǿPl_______P2����������������С��������N��v��_______M��v������������������С����������Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K=________��ƽ������������м���1 mol CH4��1 mol CO��ƽ��_______�ƶ�����������Ӧ�����������淴Ӧ������������������