题目内容
5.下列各组混合物不能用分液漏斗分离的是( )| A. | 硝基苯和水 | B. | 苯和甲苯 | C. | 乙苯和水 | D. | 溴苯和NaOH溶液 |
分析 能用分液漏斗分离的物质,应为互不相溶的液体,以此解答.
解答 解:A.硝基苯和水互不相溶,可用分液的方法分离,故A正确;
B.苯和甲苯互溶,不能用分液的方法分离,故B错误;
C.乙苯和水互不相溶,可用分液的方法分离,故C正确;
D.溴苯和NaOH溶液互不相溶,可用分液的方法分离,故D正确.
故选B.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
12.“喷水溶液法”是日本科学家最近研制的一种使沙漠变绿洲的技术,先是在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙粒结合,在地表下30-50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有蓄积雨水的作用,下列对聚丙烯酸酯的说法中正确的是( )
| A. | 聚丙烯酸酯的单体的结构简式为:CH2=CH-COOR | |
| B. | 聚丙烯酸酯在一定条件下能发生加成反应 | |
| C. | 聚丙烯酸酯不能发生水解反应 | |
| D. | 聚丙烯酸酯有固定的熔沸点 |
10.下表是有机物A、B的有关信息.
根据表中信息回答下列问题:
(1)A的名称为乙烯,A在一定条件下生成高分子化合物的反应方程式 .
.
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一
大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开
始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水
反应使之褪色、⑥任何条件下不与氢气反应.
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: 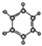 |
(1)A的名称为乙烯,A在一定条件下生成高分子化合物的反应方程式
 .
.(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一
大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开
始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水
反应使之褪色、⑥任何条件下不与氢气反应.
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.
17.下列叙述及解释正确的是( )
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
14.以丁烷为燃料、空气为氧化剂,选用具有催化作用和导电性能的稀土金属材料为电极,用熔融的K2CO3(其中不含O2-和HCO3-)为电解质组成燃料电池,下列说法中不正确的是( )
| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
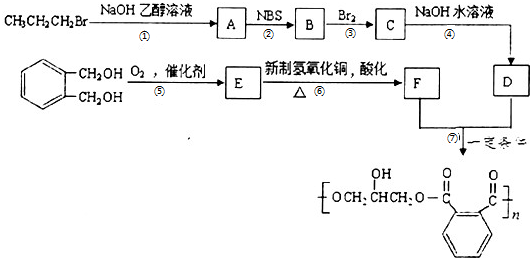
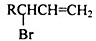
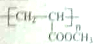 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. 的系统命名为2-甲基戊烷;.
的系统命名为2-甲基戊烷;. ③白磷 ④18O ⑤
③白磷 ④18O ⑤