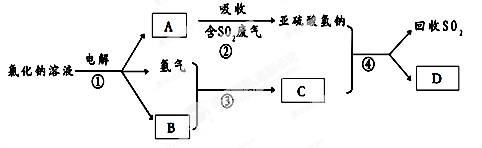
题目内容
用大试管收集一试管NO2气体,倒扣在盛水的水槽里,试管内产生的现象为 ;再往试管里通入适量氧气,试管内又产生的现象为 。产生上述现象的原因是
试管内红棕色气体逐渐消失,水面上升至试管容积的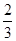 处 试管内又出现红棕色,接着红棕色消失,液面又上升。
处 试管内又出现红棕色,接着红棕色消失,液面又上升。
解析试题分析:用大试管收集一试管NO2气体,倒扣在盛水的水槽里,NO2与H2O反应:3NO2+H2O=2HNO3+NO,故颜色消失,液面上升至容积的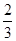 处;再充入O2时,发生反应2NO+O2=2NO2,故又出现了红棕色,NO2继续溶于水并与水反应,气体颜色又消失,液面又上升。
处;再充入O2时,发生反应2NO+O2=2NO2,故又出现了红棕色,NO2继续溶于水并与水反应,气体颜色又消失,液面又上升。
考点:本题考查NO2、NO的性质及反应现象的描述。

练习册系列答案
相关题目
光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒跟光导纤维的成分相同,那么光纤预制棒的化学成分是 。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因 。
(3)下列说法正确的是 。
| A.石英与普通玻璃都是硅酸盐制品 |
| B.二氧化硅是良好的半导体材料 |
| C.工艺师用盐酸刻蚀石英制作艺术品 |
| D.石英与二氧化碳中的化学键相同 |