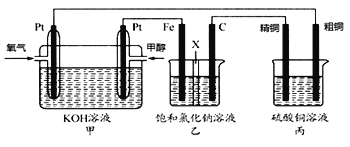
题目内容
【题目】亚氯酸钠(![]() )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①![]() 的溶解度随温度升高而增大,适当条件下可结晶析出
的溶解度随温度升高而增大,适当条件下可结晶析出![]() 。
。
②纯![]() 易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)钠元素在周期表的位置___________;![]() 的电子式____________
的电子式____________
(2)发生器中鼓入空气的作用可能是_____________(选填序号).
a.将![]() 氧化成
氧化成![]() ,增强酸性 b.稀释
,增强酸性 b.稀释![]() 以防止爆炸
以防止爆炸
c.将![]() 氧化成
氧化成![]() d.加大容器压强,加快反应速率
d.加大容器压强,加快反应速率
(3)吸收塔内发生反应的化学方程式:___________________________;
(4)从滤液中得到![]() ,粗晶体的实验操作依次是_________(选填序号)。
,粗晶体的实验操作依次是_________(选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
(5)![]() 被
被![]() 还原为
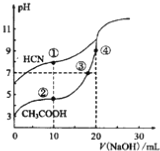
还原为![]() 的转化率与溶液pH的关系如图所示。
的转化率与溶液pH的关系如图所示。![]() 时,被S2-还原的产物ClO2-、Cl-物质的量的比______;写出
时,被S2-还原的产物ClO2-、Cl-物质的量的比______;写出![]() 时
时![]() 与
与![]() 反应的离子方程式______________________。
反应的离子方程式______________________。

Ⅱ.铁和铜及其化合物在人类生产生活中具有重要作用,回答下列问题:
(6)中国古代四大发明之一的司南由天然磁石制成。其主要成分是__________(填字母序号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(7)中国古代制造的青铜器久置空气中发生电化学腐蚀生成铜绿,则正极反应式为___________,若利用稀盐酸擦拭铜绿,其离子方程式为___________________。
【答案】第三周期第IA族 ![]() b 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 bed 1:1 2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O c O2+4e-+2H2O=4OH- Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
b 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 bed 1:1 2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O c O2+4e-+2H2O=4OH- Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
【解析】
(1)钠是11号元素,根据原子核外电子排布确定Na在周期表的位置;![]() 中两个O原子形成1对共用电子对,每个O原子分别与1个H原子形成1对共用电子对;
中两个O原子形成1对共用电子对,每个O原子分别与1个H原子形成1对共用电子对;
(2)根据纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全分析;
(3)在吸收塔内ClO2、NaOH、H2O2发生反应生成NaClO2、H2O及O2;
(4)根据NaClO2的溶解度随温度升高而增大,从NaClO2溶液中获得晶体要蒸发浓缩、冷却结晶、过滤获取;
(5)根据图示分析S2-还原ClO2所得还原产物的物质的量的比及相应的离子反应方程式;
(6)天然磁石主要成分是Fe3O4;
(7)青铜器主要成分是Cu合金,与空气中的氧气、二氧化碳、及水反应形成铜绿Cu2(OH)2CO3,铜绿与盐酸反应生成氯化铜、二氧化碳、水。
(1)钠是11号元素,Na原子的K、L、M层依次排有2、8、1个电子,所以Na在周期表的位置是第三周期第IA族;H2O2分子中两个O原子形成1对共用电子对,每个O原子分别与1个H原子形成1对共用电子对,从而使分子中每个原子都达到稳定结构,因此H2O2的电子式为![]() ;
;
(2)由于纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,所以发生器中鼓入空气的作用可能是稀释ClO2以防止爆炸;
(3)在吸收塔内ClO2、NaOH、H2O2发生反应生成NaClO2,ClO2被还原成NaClO2,则H2O2被氧化成O2,根据电子守恒、原子守恒,可得反应方程式为2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2;
(4)根据NaClO2的溶解度随温度升高而增大,从NaClO2溶液中获得晶体要蒸发浓缩、冷却结晶、过滤获取,因此合理选项是bed;
(5)根据图示可知在pH=5时,S2-还原ClO2所得还原产物为ClO2-、Cl-,二者的转化率相同,因此ClO2-、Cl-的物质的量的比是1:1;当溶液的pH≤2时,S2-将ClO2还原为Cl-,S2-被氧化成S,根据电子守恒、电荷守恒及原子守恒,可得相应的离子反应方程式2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(6)中国古代四大发明之一的司南由天然磁石制成,其主要成分是Fe3O4,故合理选项是c;
(7)中国古代制造的青铜器主要成分是Cu合金,将其久置空气中,会与空气中的氧气、CO2、H2O发生氧化还原反应生成铜绿Cu2(OH)2CO3;发生电化学腐蚀时,Cu作负极,杂质为正极,在正极上O2获得电子,发生还原反应,正极的反应式为O2+4e-+2H2O=4OH-;若利用稀盐酸擦拭铜绿,Cu2(OH)2CO3与HCl反应生成CuCl2、CO2、H2O,反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑。

【题目】下列有关化学实验操作、现象和结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向 | 溶液呈黄色 | NaHCO3溶液溶液呈碱性 |
B | 向氨水和 | 得到红褐色悬浊液 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
C | 使石蜡油蒸汽通过炽热的碎瓷片,再将产生的气体通过酸性KMnO4溶液 | KMnO4溶液褪色 | 石蜡油蒸汽中含有烯烃 |
D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
A. AB. BC. CD. D