题目内容
【题目】已知室温时,0.1mol/L某一元酸HA 在水中电离度为0.02%,回答下列各问题:
(1)该溶液中c(H+)=_________。
(2)HA的电离平衡常数K=_________;
(3)升高温度时,K_________ (填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的_______倍。
【答案】2×10-5mol/L 4×10-9 增大 4×104
【解析】
根据题中一元酸HA 在水中电离度为0.02%可知,本题考查电离平衡常数的计算、温度对电离平衡的影响,运用电离平衡常数等于溶液中的电离出来的各离子浓度乘积与溶液中未电离的电解质分子浓度的比值、升高温度促进电离分析。
(1)该溶液中c(H+)=0.1mol/L×0.02%=2×10-5mol/L,
故答案为:2×10-5mol/L;
(2)HA= H++A-,则HA 电离平衡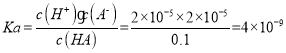
故答案为:4×10-9;
(3)一元酸HA属于弱电解质,弱电解质的电离是吸热反应,升温促进弱电解质电离,所以电离平衡常数增大。
故答案为:增大
(3)溶液中HA电离的c(H+)=2×10-5mol/L,水电离出的![]() ,所以由HA电离出的c(H+)与水电离出的c(H+)比=2×10-5mol/L: 5×10-10mol/L =4×104,
,所以由HA电离出的c(H+)与水电离出的c(H+)比=2×10-5mol/L: 5×10-10mol/L =4×104,
故答案为:4×104。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
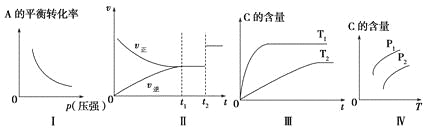
小学生10分钟应用题系列答案【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则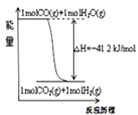 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.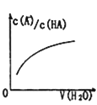 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,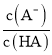 的变化情况
的变化情况