题目内容
一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08
D
解析

练习册系列答案
相关题目
下列反应中,同时符合图像Ⅰ和Ⅱ的是
A.N2(g)+3H2(g)  2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g)  2SO2(g)+O2(g) ΔH>0 2SO2(g)+O2(g) ΔH>0 |
C.H2(g)+CO(g)  C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
D.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)  NH3(g) + HI(g) ②2HI(g)
NH3(g) + HI(g) ②2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,c(H2)=0.5mol/L,c(NH3)=4mol/L,则此温度下反应①的平衡常数为
| A.9 | B.12 | C.16 | D.20 |
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+ ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
| A.升高温度 | B.加水稀释 |
| C.增大Fe2+的浓度 | D.常温下加压 |
在一定温度下,将等物质的量的CO和水蒸气通入恒容密闭容器中,发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
| A.正反应速率等于零 |
| B.正反应速率大于逆反应速率 |
| C.正反应速率等于逆反应速率 |
| D.正反应速率小于逆反应速率 |
在2NO2 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
| A.N2O4和NO2的分子数比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.平衡体系的颜色不再改变 |
| D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成 |
反应2SO2+O2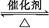 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
| A.0.1 s | B.2.5 s | C.10 s | D.5 s |
下列关于催化剂的说法不正确的是( )
| A.温度越高,催化剂的催化效果越好 |
| B.汽车排气管上的“催化转化器”能减少有害气体排放 |
| C.催化剂可以改变化学反应速率,但反应前后质量和化学性质不变 |
| D.锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂 |
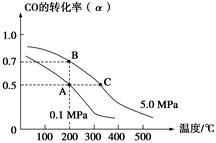
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是( )