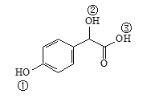
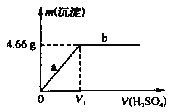
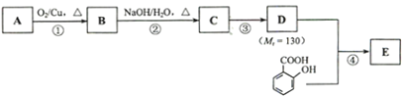
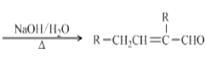
题目内容
【题目】在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1)铁粉与水蒸气反应的化学方程式是: __________________________________________
(2)证明还原铁粉与水蒸气发生了反应的方法是_________________________________________
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
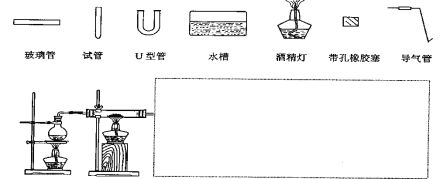 __________
__________
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混和物中既有Fe3+又有Fe2+,则证明该结论的实验方法:_________________________________________
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)___________________________________________
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。沉淀由白色→红褐色的化学方程式是:_________________________
【答案】3Fe+4H2O(g) ![]() Fe3O4+4H2 检验是否有H2产生,收集气体进行爆鸣实验
Fe3O4+4H2 检验是否有H2产生,收集气体进行爆鸣实验 ![]() 各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+ 如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+ 如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3;
【解析】
(1)铁粉与水蒸气反应生成四氧化三铁和氢气;
(2)证明还原铁粉与水蒸气发生了反应的方法主要是检验是否有H2产生,收集气体进行爆鸣实验;
(3)前面是发生装置已经设计好,只需要设计验证装置,用试管收集产生的气体,因此用导气管、水槽、试管或则用U型管、试管,导气管、橡胶塞;
(4)若混和物中既有Fe3+又有Fe2+,证明含有铁离子一般用KSCN来鉴别,观察溶液颜色变化,而检验铁离子溶液中含有亚铁离子,一般加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+;
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含十3价的Fe元素,主要是铁和铁离子反应生成亚铁离子;
(6)沉淀由白色→红褐色主要是氢氧化亚铁、氧气和水反应生成氢氧化铁。
(1)铁粉与水蒸气反应生成四氧化三铁和氢气,其化学方程式是:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)证明还原铁粉与水蒸气发生了反应的方法主要是检验是否有H2产生,收集气体进行爆鸣实验;
(3)前面是发生装置已经设计好,只需要设计验证装置,用试管收集产生的气体,因此用导气管、水槽、试管或则用U型管、试管,导气管、橡胶塞,装置是![]() ;
;
(4)若混和物中既有Fe3+又有Fe2+,证明含有铁离子一般用KSCN来鉴别,观察溶液颜色变化,而检验铁离子溶液中含有亚铁离子,一般加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+;
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素,主要是铁和铁离子反应生成亚铁离子;
(6)沉淀由白色→红褐色主要是氢氧化亚铁、氧气和水反应生成氢氧化铁,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。

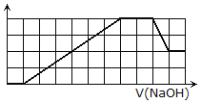
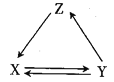
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D