题目内容
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
【答案】C
【解析】
观察装置可知,X电极V由+5的VO2+→+4的VO2+,发生得电子的还原反应,即X电极为正极,电极反应式为VO2++e-+2H+=VO2++H2O,Y电极上V2+→V3+,发生失去电子的氧化反应,为负极,电极反应式为V2+-e-=V3+,总反应为V2++VO2++2H+=VO2++V3++H2O,原电池工作时,电子由负极Y经过用电器移向正极X,溶液中的H+由负极Y经过质子交换膜移向正极X,据此分析解答。
A.该原电池中,X电极为正极,Y电极为负极,原电池工作时,电子只能在导线上迁移,即电子由Y极经导线流向X极,故A错误;
B.放电过程中,电池总反应为V2++VO2++2H+=VO2++V3++H2O,消耗了H+,溶液酸性减弱,pH升高,故B错误;
C.充电时,X为阳极,失去电子,发生氧化反应,X极反应式为:VO2++H2O -e- = VO2++2H+,故C正确;
D.X极为正极,电极反应式为VO2++e-+2H+=VO2++H2O,由于得失电子数等于氢离子迁移数目,所以转移1mol电子,只有1mol H+迁移,故D错误;
故选:C。

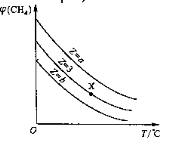
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_________,X的转化率为________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是_______。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________(填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
【题目】反应①![]()
![]()
②![]()
![]()
在不同温度时![]() 、
、![]() 的值如表:
的值如表:
温度 |
|
|
973 |
|
|
1173 |
|
|
据此可知反应③:“![]()
![]() ”的相关信息正确的是( )
”的相关信息正确的是( )
A.![]()
B.该反应正反应为吸热反应
C.该反应进行时不断分离出![]() ,可以提高
,可以提高![]() 的转化率和反应速率
的转化率和反应速率
D.在恒温且容积可变的容器中发生反应③,压缩体积反应速率会增大,![]() 也增大
也增大