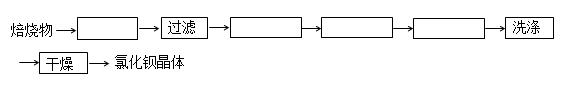题目内容
含苯酚的工业废水处理的流程图如图所示:
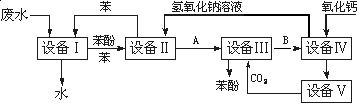
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步
操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_____ ____。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______ ________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)

(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步
操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_____ ____。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______ ________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)
(1)萃取(或萃取、分液),分液漏斗 (2)C6H5ONa NaHCO3
(3)C6H5ONa+CO2+H2O C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2
C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2
(3)C6H5ONa+CO2+H2O
 C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2
C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2试题分析:在设备Ⅰ中废水中的苯酚不容易溶解于水而容易溶解于苯中,苯与水互不相溶。所以在该装置中进行的操作是萃取(或萃取、分液)。使用的仪器是分液漏斗。在设备Ⅱ中发生反应:C6H5-OH+NaOH
 C6H5-ONa+H2O.在设备Ⅲ中发生反应:C6H5-ONa+H2O+CO2= C6H5-OH+NaHCO3.苯酚被分离出来,NaHCO3及未反应的C6H5-ONa进入设备Ⅳ。在设备Ⅳ中,发生反应CaO+H2O=Ca(OH)2, Ca(OH)2+NaHCO3= CaCO3↓+ NaOH+H2O.产生的CaCO3沉淀通过过滤分离出来。由物质制备流程示意图可知:能循环使用的物质是C6H6、CaO:CO2、NaOH溶液。
C6H5-ONa+H2O.在设备Ⅲ中发生反应:C6H5-ONa+H2O+CO2= C6H5-OH+NaHCO3.苯酚被分离出来,NaHCO3及未反应的C6H5-ONa进入设备Ⅳ。在设备Ⅳ中,发生反应CaO+H2O=Ca(OH)2, Ca(OH)2+NaHCO3= CaCO3↓+ NaOH+H2O.产生的CaCO3沉淀通过过滤分离出来。由物质制备流程示意图可知:能循环使用的物质是C6H6、CaO:CO2、NaOH溶液。H考点:

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
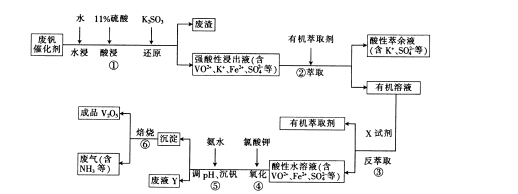
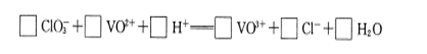
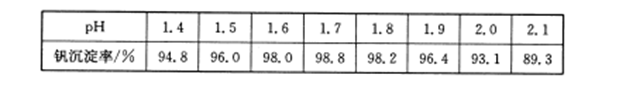
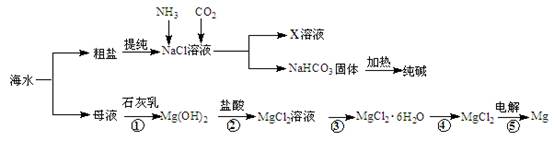
 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。