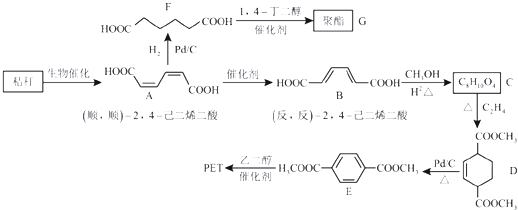
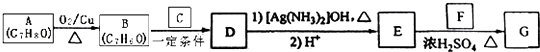题目内容
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 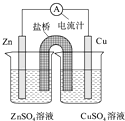
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
【答案】D
【解析】解:A.该原电池中,易失电子的锌作负极,铜作正极,故A正确;
B.该原电池中,易失电子的锌作负极,铜作正极,电子从锌沿导线流向铜,故B正确;
C.该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,所以电池反应式为:Zn+Cu2+=Zn2++Cu,故C正确;
D.原电池放电时,盐桥中钾离子向正极电解质溶液硫酸铜溶液移动,故D错误;
故选D.
该原电池中,易失电子的锌作负极,铜作正极,电子从锌沿导线流向铜,盐桥中阳离子向正极移动.

【题目】冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
![]()
己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤如下:
步骤1:在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计示数约105℃,小火加热回流1h。
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________________________。
(2)步骤2加热可用_________________(填“水浴”或“油浴”)
(3)锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4)步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5)纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6)请计算所得到乙酰苯胺的产率是_________________________________________________。