��Ŀ����
11����Ũ��Ϊ0.1mol•L-1�����ᡢ���ᡢ����������Һ���Իش���1��������Һ��c��H+�� ����Ϊa mol•L-1��b mol•L-1��c mol•L-1�����С˳��Ϊa=$\frac{1}{2}$b��c��
��2�������������������ֱ��������NaOH ��Һ��Ӧ�����ɵ��ε����ʵ�������Ϊn 1mol��n2 mol��n3 mol�����ǵĴ�С��ϵΪn1 =n2=n3
��3���к�һ����NaOH��Һ��������ʱ������������������������V1L��V2L��V3L�����С��ϵΪV1=2V2=V3
��4����п��Ӧʱ�����⣨���������ʷֱ�Ϊv1��v2��v3�����С��ϵΪv2��v1��v3����һ�������·�����Ӧ2SO2��g��+O2��g��2SO3��g������H��0��
���� ��1���������ǿ����ʣ�һԪ���Ũ����������Ũ����ȣ���Ԫ���Ũ��Ϊ������Ũ�ȵ�һ�룻�������������ʣ�һԪ���Ũ�ȴ���������Ũ�ȣ�
��2�������������غ�֪���ε����ʵ�����������ʵ�����ȣ�
��3���к�һ����NaOH��Һ��������ʱ�����Ũ�����ʱ�������һԪ�ᣬ������������ȣ�����Ƕ�Ԫ�ᣬ��������һԪ���һ�룻
��4����п��Ӧʱ�����⣨������������������Ũ�ȳ����ȣ�������Ũ��Խ��Ӧ����Խ��
��� �⣺��1���Ȼ����������ǿ����ʣ�������һԪ�ᣬ�����Ƕ�Ԫ�ᣬ�����������������һԪ�ᣬ����������������Ũ�������Ũ����ȣ�������������Ũ���������Ũ�ȵ�2����������������Ũ��С�ڴ����Ũ�ȣ�����������Ũ�����С˳��Ϊa=$\frac{1}{2}$b��c���ʴ�Ϊ��a=$\frac{1}{2}$b��c��
��2�������������غ�֪���ε����ʵ�����������ʵ�����ȣ��������ɵ��ε����ʵ�����С��ϵΪn1 =n2=n3���ʴ�Ϊ��n1 =n2=n3��
��3���к�һ����NaOH��Һ��������ʱ�����Ũ����ȣ������һԪ�ᣬ������������ȣ�����Ƕ�Ԫ�ᣬ��������һԪ���һ�룬����������������С��ϵ��V1=2V2=V3��
�ʴ�Ϊ��V1=2V2=V3��
��4����п��Ӧʱ�����⣨������������������Ũ�ȳ����ȣ�������Ũ��Խ��Ӧ����Խ����������������������Ũ��Ϊ0.2mol/L��������������Ũ��Ϊ0.1mol/L��������������Ũ��С��0.1mol/L�����Է�Ӧ���ʴ�С��ϵΪv2��v1��v3���ʴ�Ϊ��v2��v1��v3��
���� ���⿼����������ʵĵ��룬�ѶȲ���ע�⣨4�������������ķ�Ӧ������������Ũ�ȳ����ȣ������dz�ʼ���ʻ���Ӧ�����еķ�Ӧ���ʣ�

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�| A�� | NaCl | B�� | NaOH | C�� | �ƾ� | D�� | CH3COOH |
| A�� | ��״���£�2.24L����Լ����3.612��1023��̼ԭ�� | |
| B�� | ���³�ѹ�£������ͳ����Ļ����16g��Լ����6.02��1023����ԭ�� | |
| C�� | 1L 1mol/L������Һ����������Ϊ1.204��l024 | |
| D�� | 0.5mol CH4��Լ����3.01��1023������ |
��NaOH ��AgNO3 ��Na2CO3 ��NaBr ��KI��
| A�� | ֻ�Т٢� | B�� | ֻ�Т٢ܢ� | C�� | ֻ�Тڢܢ� | D�� | �٢ڢۢܢ� |
| A�� | ��ϩ������8���Ҽ���1���м� | |
| B�� | ��ϩ������3��̼ԭ�Ӷ���sp3�ӻ� | |
| C�� | ��ϩ���Ӵ��ڷǼ��Լ� | |
| D�� | ��ϩ������3��̼ԭ����ͬһֱ���� |
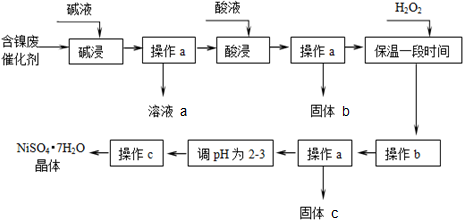
����������������������ʽ����ʱ��pH���£�
| ������ | ��ʼ���� | ��ȫ���� |
| Al��OH��3 | 3.8 | 5.2 |
| Fe��OH��3 | 2.7 | 3.2 |
| Fe��OH��2 | 7.6 | 9.7 |
| Ni��OH��2 | 7.1 | 9.2 |
��2��������������з�����Ӧ�����ӷ���ʽ��2Al+2OH-+2H2O�T2AlO2-+3H2����Al2O3+2OH-�T2AlO2-+H2O��
��3���������ʱ�����������H2SO4���ѧʽ����
��4������bΪ������Һ��pH������ΪpH����ѵ��ط�Χ��3.2-7.1��
��5����Һa�м���������Ƶ�AlCl3��Һ��AlCl3��Һ�������Ʊ��ۺ��Ȼ������ۺ��Ȼ�����һ�����;�ˮ������������Ҫ��[AlO2Al12��OH��24•��H2O��12]2+����Alx��ʾ������ʽ���ڣ�
��д������Һa�����ᷴӦ�Ʊ�AlCl3�����ӷ���ʽ��AlO2-+4H+=Al3++2H2O��
��һ�������£���1.0mol•L-1��AlCl3��Һ�м���0.6mol•L-1��NaOH��Һ�����Ƶ�Aln����ԼΪ86%�ľۺ��Ȼ�����Һ��д������[AlO4Al12��OH��24•��H2O��12]7+�����ӷ���ʽ��13Al3++32OH-+8H2O=[AlO4Al12��OH��24��H2O��12]7+��
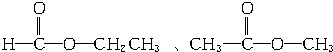 ��
��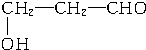 ��
��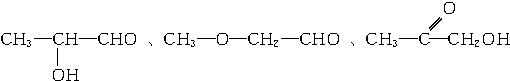 ��
��