��Ŀ����
I����֪��25��ʱ�����ᡢ̼���������ĵ���ƽ�ⳣ���ֱ�Ϊ������ K=1.75×10-5
̼�� K1=4.30×10-7 K2=5.61×10-11
������ K1=1.54×10-2 K2=1.02×10-7
��1��д��̼��ĵ�һ������ƽ�ⳣ������ʽ��K1=______��
��2������ͬ�����£��ԱȽ�CH3COONa��Na2CO3��Na2SO3ˮ��Һ�ļ���ǿ����______��______��______��
��3������ͬ�����£��ԱȽ�ͬŨ��ͬ���H2SO3��NaHSO3��Na2SO3��Һ�����ӵ���Ŀ��______��______��______��
��4���������¶Ȳ��䣬�ڴ�����Һ�м����������ᣬ���������С����______������ţ���
A��c��CH3COO-�� B��c��H+�� C���������ƽ�ⳣ�� D������ĵ���̶�
II��ij��������ˮ�к���Ag+��Pb2+���ؽ������ӣ���Ũ�ȸ�ԼΪ0.01mol?L-1���ŷ�ǰ���ó�������ȥ���������ӣ������й��������£�
| ���ܵ���� | AgI | AgOH | Ag2S | PbI2 | Pb��OH��2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A��NaOH B��Na2S C�� KI D��Ca��OH��2
��6�������ʳ�δ�����ֻ��Ag+�ķ�ˮ����ô�����ķ�ˮ��NaCl����������Ϊ0.117%��������Ҫ���ŷű�Ϊc��Ag+������1.0×10-8mol?L-1���ʸù���������ķ�ˮ��c��Ag+��=______[��֪��Ksp��AgCl��=c��Ag+��?c��Cl-��=1.8×10-10mol2?L-2]��
���𰸡���������1��̼��ĵ�һ�����뷽��ʽΪH2CO3?H++HCO3-������ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��
��2������Խ�����������ӵ�ˮ���Խ����ˮ��̶���С��Ϊ�����ƣ�ˮ��̶�����Ϊ̼���ƣ���
��3������ǿ������ʼ����ǵ����ʵ����͵�����ˮ����������ͬŨ�ȵ�������Һ�����ӵ���Ŀ��
��4����������ᣬ����ĵ���ƽ�������ƶ�����c��CH3COO-����С������ĵ���̶ȼ�С�����¶Ȳ��䣬��������ƽ�ⳣ�����䣬������ʱc��H+������
��5�����ݱ����е��ܶȻ����ܶȻ�ԽСʱ����Ч��Խ����������
��6�����������ӵ�Ũ�ȼ��Ȼ������ܶȻ������㣮
����⣺��1��̼��ĵ�һ�����뷽��ʽΪH2CO3?H++HCO3-������ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ����K1= ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2��CH3COONa��Na2CO3��Na2SO3�����ζ�Ӧ����Ϊ���ᡢHCO3-��HSO3-���ɴ���ĵ���ƽ�ⳣ��K���������K2��̼���K2������Խ�����������ӵ�ˮ���Խ����ˮ��̶���С��Ϊ�����ƣ�ˮ��̶�����Ϊ̼���ƣ��ʴ�Ϊ��Na2CO3��Na2SO3��CH3COONa��
��3����ͬ�����£�ͬŨ��ͬ���H2SO3��NaHSO3��Na2SO3��Һ�У��������ʵ����ʵ�����ͬ��ֻ��������Ϊ������ʣ������ӵ���Ŀ���٣���NaHSO3��Na2SO3Ϊǿ����ʣ���ͬ���ʵ���ʱ�������������ӵ���Ŀ�࣬��NaHSO3��Na2SO3��Һ��ˮ�������ij̶ȶ���С���ʴ�Ϊ��Na2SO3��NaHSO3��H2SO3��
��4����������ᣬ����ĵ���ƽ�������ƶ�����c��CH3COO-����С������ĵ���̶ȼ�С�����¶Ȳ��䣬��������ƽ�ⳣ�����䣬������ʱc��H+�����ʴ�Ϊ��AD��
��5���ɱ����е��ܶȻ����ݿ�֪��Ag2S��PbS���ܶȻ���С�������Na2S����Ч����ã��ʴ�Ϊ��B��
��6����ˮ��NaCl����������Ϊ0.117%���ѡ�1g?mL-1����c��Cl-��=c��NaCl��=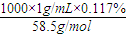 =0.02mol/L��
=0.02mol/L��
Ksp��AgCl��=c��Ag+��?c��Cl-��=1.8×10-10mol2?L-2��
��c��Ag+��= =9×10-9mol?L-1���ʴ�Ϊ��9×10-9mol?L-1��
=9×10-9mol?L-1���ʴ�Ϊ��9×10-9mol?L-1��
������������ѣ�����ѧ��Ӧ�õ���ƽ�ⳣ�����ܶȻ�������������⣬ע���˶����ݵķ�����Ӧ�ã��Ϻõ�ѵ��ѧ��������������������
��2������Խ�����������ӵ�ˮ���Խ����ˮ��̶���С��Ϊ�����ƣ�ˮ��̶�����Ϊ̼���ƣ���
��3������ǿ������ʼ����ǵ����ʵ����͵�����ˮ����������ͬŨ�ȵ�������Һ�����ӵ���Ŀ��
��4����������ᣬ����ĵ���ƽ�������ƶ�����c��CH3COO-����С������ĵ���̶ȼ�С�����¶Ȳ��䣬��������ƽ�ⳣ�����䣬������ʱc��H+������
��5�����ݱ����е��ܶȻ����ܶȻ�ԽСʱ����Ч��Խ����������
��6�����������ӵ�Ũ�ȼ��Ȼ������ܶȻ������㣮
����⣺��1��̼��ĵ�һ�����뷽��ʽΪH2CO3?H++HCO3-������ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ����K1=
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����2��CH3COONa��Na2CO3��Na2SO3�����ζ�Ӧ����Ϊ���ᡢHCO3-��HSO3-���ɴ���ĵ���ƽ�ⳣ��K���������K2��̼���K2������Խ�����������ӵ�ˮ���Խ����ˮ��̶���С��Ϊ�����ƣ�ˮ��̶�����Ϊ̼���ƣ��ʴ�Ϊ��Na2CO3��Na2SO3��CH3COONa��
��3����ͬ�����£�ͬŨ��ͬ���H2SO3��NaHSO3��Na2SO3��Һ�У��������ʵ����ʵ�����ͬ��ֻ��������Ϊ������ʣ������ӵ���Ŀ���٣���NaHSO3��Na2SO3Ϊǿ����ʣ���ͬ���ʵ���ʱ�������������ӵ���Ŀ�࣬��NaHSO3��Na2SO3��Һ��ˮ�������ij̶ȶ���С���ʴ�Ϊ��Na2SO3��NaHSO3��H2SO3��
��4����������ᣬ����ĵ���ƽ�������ƶ�����c��CH3COO-����С������ĵ���̶ȼ�С�����¶Ȳ��䣬��������ƽ�ⳣ�����䣬������ʱc��H+�����ʴ�Ϊ��AD��
��5���ɱ����е��ܶȻ����ݿ�֪��Ag2S��PbS���ܶȻ���С�������Na2S����Ч����ã��ʴ�Ϊ��B��
��6����ˮ��NaCl����������Ϊ0.117%���ѡ�1g?mL-1����c��Cl-��=c��NaCl��=
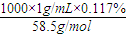 =0.02mol/L��
=0.02mol/L��Ksp��AgCl��=c��Ag+��?c��Cl-��=1.8×10-10mol2?L-2��
��c��Ag+��=
 =9×10-9mol?L-1���ʴ�Ϊ��9×10-9mol?L-1��
=9×10-9mol?L-1���ʴ�Ϊ��9×10-9mol?L-1��������������ѣ�����ѧ��Ӧ�õ���ƽ�ⳣ�����ܶȻ�������������⣬ע���˶����ݵķ�����Ӧ�ã��Ϻõ�ѵ��ѧ��������������������

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
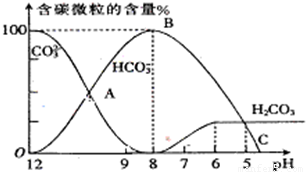
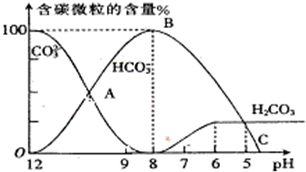 I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺
I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺ H++HA-����HA-
H++HA-����HA- H++A2-
H++A2-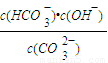 =2×10-4������Һ��c��HCO3-����c��CO32-��=2��1ʱ����Һ��pH=______��
=2×10-4������Һ��c��HCO3-����c��CO32-��=2��1ʱ����Һ��pH=______�� H++HA- HA-
H++HA- HA- H++A2-
H++A2-