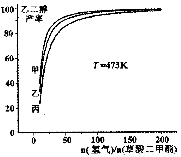
题目内容
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H ="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。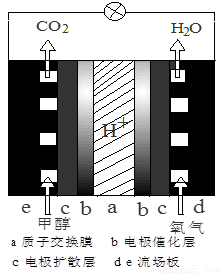
(14分)每空2分
(1)- 59.6 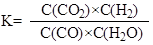
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此时催化剂亚铬酸锌的活性最大(或温度升高,反应速率增大)
②促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
【解析】
试题分析:(1)通过热化学方程式的叠加,CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= - 59.6。
化学平衡常数等于生成物浓度的幂之积除以反应物难度的幂之积,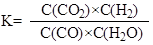 。
。
(2)①根据题中的反应物、生成物,反应的方程式为2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O。
温度对化学反应的速率影响较大且催化剂需要适当的温度活性才大,故工业上的适宜温度是:350℃~420℃,可能的原因是此时催化剂亚铬酸锌的活性最大(或温度升高,反应速率增大)。
②应为加入浓盐酸会发生CuCl + HCl H[CuCl2],故实验过程中加入浓盐酸的目的是,促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行。
H[CuCl2],故实验过程中加入浓盐酸的目的是,促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行。
Ksp(CuCl)= c(Cl-) ×c(Cu+-)=1.7×10-7,c(Cl-)=2×10-3 mol·L—1,故c(Cu+-)8.5×10-5 mol·L—1。
(3)甲醇燃料电池中,甲醇是负极,失去电子,化合价所给,电极式为CH3OH+H2O-6e-=CO2+6H+。
考点:反应热的计算 平衡常数的计算 化学方程式的书写 燃料电池 溶度积 电极式的书写
点评:本题考查反应热的计算、平衡常数的计算、化学方程式的书写、燃料电池、溶度积、电极式的书写等知识,题目难度较大,注意题中信息的利用。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | 20 | 40 | 60 | 80 | |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol?L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式______.
 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题: H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示: