题目内容
有效利用现有资源是解决能源问题的一种实际途径。发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=_____________。
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)燃烧热的热化学方程式_____________。
(3)“催化还原”反应制乙二醇原理如下: CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
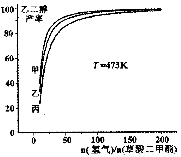
为探究实际生产的最佳条件,某科研小组进行了多方面研究。如图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强是P(丙)=_____________。
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸①草酸氢钾溶液中存? 在如下平衡: H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和____________。
H++C2O42-和____________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液中各粒子浓度关系正确的是__________(填序号)。
A.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
B.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
C.c(Na+)=c(H2C2O4)+c(C2O42-)
D.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替3.2g甲醇,所需标准状况下的甲烷的体积为____________L。
(1)
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)? ΔH=--650KJ/mol
(3)1. 5Mpa;
(4)? ①HC2O4-+H2O=H2C2O4+OH-. ②? B D
(5) CH3OH+ H2O-6e-= CO2+6H+。1.68
【解析】
试题分析: (1)CO和水蒸汽反应的化学方程式为:CO(g)+H2O(g)  CO2(g)+H2(g)。化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度幂指数乘积的比。因此根据平衡常数的定义可得该反应的化学平衡常数的表达式为:
CO2(g)+H2(g)。化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度幂指数乘积的比。因此根据平衡常数的定义可得该反应的化学平衡常数的表达式为: 。(2) 燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O(l)? ΔH=--650KJ/mol (3)由制取乙二醇的想方程式CH3OOC—COOCH3(g)+4H2(g)
。(2) 燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O(l)? ΔH=--650KJ/mol (3)由制取乙二醇的想方程式CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol 可以看出:在相同的投料比时,压强越大,化学反应速率越快,达到平衡所需要的时间就越短。因为丙对应的反应达到平衡所需要的时间最长,所以应该是压强最小的1.5MPa的情况。(4)草酸(H2C2O4)为二元中强酸,所以草酸氢钾是强碱弱酸盐。在其溶液中存在的弱电解质的电离平衡H2O
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol 可以看出:在相同的投料比时,压强越大,化学反应速率越快,达到平衡所需要的时间就越短。因为丙对应的反应达到平衡所需要的时间最长,所以应该是压强最小的1.5MPa的情况。(4)草酸(H2C2O4)为二元中强酸,所以草酸氢钾是强碱弱酸盐。在其溶液中存在的弱电解质的电离平衡H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-及弱酸根离子的水解平衡:HC2O4-+H2O
H++C2O42-及弱酸根离子的水解平衡:HC2O4-+H2O H2C2O4+OH-。②A.任何溶液都存在着电荷守恒。所以有关系:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-).因为溶液呈中性,所以c(H+)=c(OH-)。两式相减可得:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-).错误。B.根据物料守恒可得c(K+)=c(HC2O4-)(始)= c(HC2O4-)+c(H2C2O4)+c(C2O42-)。正确。C. 根据A可知c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-).而c(K+)=c(HC2O4-)(始)= c(HC2O4-)+c(H2C2O4)+c(C2O42-),所以c(Na+)=c(C2O42-) —c(H2C2O4).错误。KHC2O4电离使溶液显酸性,c(K+)=c(HC2O4-)(始),c(Na+)= c(HC2O4-)(电离)。但是弱酸根离子HC2O4-电离程度是很微弱的,c(HC2O4-)(始)> c(HC2O4-)(电离)。所以c(K+)>c(Na+)。正确。因此选项为B、D。(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极为甲醇,电极反应式为CH3OH+ H2O-6e-= CO2+6H+,发生氧化反应;正极为O2,电极反应式为O2+ 4e-+ 4H+=2H2O.n(CH3OH)=3.2g÷32g/mol=0.1mol.所以根据电极反应式可知电子转移0.6mol,而每mol的甲烷在反应时转移电子8mol,因此需要消耗甲烷的物质的量为0.6mol÷8=0.075mol. 故所需标准状况下的甲烷的体积为0.075mol×22.4L/mol=1.68L.
H2C2O4+OH-。②A.任何溶液都存在着电荷守恒。所以有关系:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-).因为溶液呈中性,所以c(H+)=c(OH-)。两式相减可得:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-).错误。B.根据物料守恒可得c(K+)=c(HC2O4-)(始)= c(HC2O4-)+c(H2C2O4)+c(C2O42-)。正确。C. 根据A可知c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-).而c(K+)=c(HC2O4-)(始)= c(HC2O4-)+c(H2C2O4)+c(C2O42-),所以c(Na+)=c(C2O42-) —c(H2C2O4).错误。KHC2O4电离使溶液显酸性,c(K+)=c(HC2O4-)(始),c(Na+)= c(HC2O4-)(电离)。但是弱酸根离子HC2O4-电离程度是很微弱的,c(HC2O4-)(始)> c(HC2O4-)(电离)。所以c(K+)>c(Na+)。正确。因此选项为B、D。(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极为甲醇,电极反应式为CH3OH+ H2O-6e-= CO2+6H+,发生氧化反应;正极为O2,电极反应式为O2+ 4e-+ 4H+=2H2O.n(CH3OH)=3.2g÷32g/mol=0.1mol.所以根据电极反应式可知电子转移0.6mol,而每mol的甲烷在反应时转移电子8mol,因此需要消耗甲烷的物质的量为0.6mol÷8=0.075mol. 故所需标准状况下的甲烷的体积为0.075mol×22.4L/mol=1.68L.
考点:考查化学平衡常数的表达式、外界条件对化学平衡的影响、热化学方程式的书写、微粒浓度的比较、弱电解质的电离平衡及水解平衡、原电池反应原理及有关计算的知识。

 智慧小复习系列答案
智慧小复习系列答案