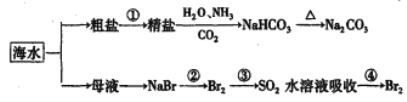
题目内容
【题目】某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
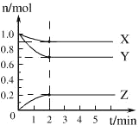
(1)反应进行至_________min 时达到平衡状态,此时 Y 的平均反应速率是________mol/ (L·min)。
(2)分析有关数据,写出 X、Y、Z 的反应方程式_________________;
(3)对于一个未知反应,影响反应速率的因素很多,请写出可能影响化学反应速率的三个因素:______________,____________,__________________。
【答案】2 0.03 X+3Y![]() 2Z 温度 浓度 催化剂等
2Z 温度 浓度 催化剂等
【解析】
(1)当物质的物质的量都不发生变化时,反应达到平衡状态;据v=![]() 计算反应速率;
计算反应速率;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据影响反应速率的外界条件分析。
(1)根据图象可知:当反应进行到2min时,各种物质的物质的量不再发生变化,反应开始至2 min时,Y的物质的量减少了1.0mol-0.7mol=0.3mol,所以用Y物质表示的反应速率v(Y)=![]() =0.03mol/(Lmin);
=0.03mol/(Lmin);
(2)根据图象可知气体X、Y的物质的量减小,气体Z的物质的量增加,说明X和Y是反应物,Z是生成物,且三种物质改变的物质的量分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,2min后三种物质的物质的量都不发生变化,说明反应为可逆反应,故反应方程式为X+3Y![]() 2Z;
2Z;
(3)对于一个未知反应,影响反应速率的因素很多,可能影响化学反应速率的因素有温度、催化剂、浓度、压强等。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命。
![]() 陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了
陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了![]() 、
、![]() 外还 ______,玻璃制作过程中发生了
外还 ______,玻璃制作过程中发生了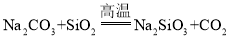 的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生? ______。
![]() 工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
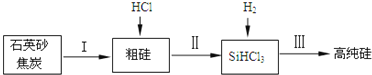
![]() 请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ ______、Ⅲ ______。
![]() 在流化床反应的产物中,
在流化床反应的产物中,![]() 大约占
大约占![]() ,所含有的其它物质的沸点数据如下表:
,所含有的其它物质的沸点数据如下表:
物质 | Si |
|
|
|
| HCl |
|
沸点 | 2355 |
|
|
|
|
|
|
提纯![]() 的主要工艺操作依次是沉降、冷凝和分馏
的主要工艺操作依次是沉降、冷凝和分馏![]() 相当于多次蒸馏
相当于多次蒸馏![]() 。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
。沉降是为了除去 ______ ;在空气中冷凝所得液体主要含有 ______ ;若在实验室进行分馏提纯液体,应该采取以下加热方法中的 ______。
A.电炉加热![]() 酒精灯加热
酒精灯加热![]() 砂浴加热
砂浴加热![]() 水浴加热
水浴加热
![]() 极易水解,其完全水解时的反应方程式为 ______。
极易水解,其完全水解时的反应方程式为 ______。