��Ŀ����
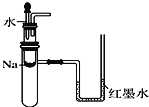
����Ŀ��Ĥ����ԭ���ڻ������������Ź㷺��Ӧ�ã������������õ绯ѧԭ���Ʊ������������ɫ������N2O5��װ��ͼ���¡�����˵������ȷ����
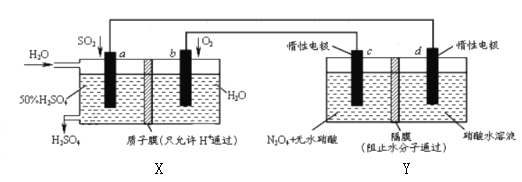
A. X��ԭ��أ��ܹ���������;Y�ǵ��أ��ܹ�����N2O5
B. C�缫�ĵ缫��Ӧ����ʽΪN2O4+2HNO3-2e-=2N2O5+2H+
C. ����·��ͨ��2mole��X��Y�и���2molH+�����Ǩ�Ƶ��ұ�
D. ��·�е�������Ϊa![]() d
d![]() c
c![]() b
b![]() a�γɱպϻ�·
a�γɱպϻ�·
���𰸡�D
��������A����װ��ͼ��֪XΪԭ��أ�a��������a���ϵ�SO2ʧȥ���ӽ��ˮ����H2SO4��b��������O2�õ����ӽ����Һ�е�H+����ˮ��Y�ǵ��أ�c��������N2O4ʧȥ��������N2O5��d������������õ���������NO2������A��ȷ��B��CΪ��������缫�ķ�Ӧ����ʽΪN2O4+2HNO3-2e-=2N2O5+2H+�����ɵ�H+ͨ����Ĥ��������������B��ȷ��C�����ݵ��Ӻ�H+���������ȣ�ֻ�ǵ����෴����װ�ù���ʱ��ԭ���X��H+�Ӹ���a(���)Ǩ�Ƶ�����b(�ұ�)�����ڵ���Y��H+������c(���)Ǩ�Ƶ�����d(�ұ�)�����Ե���·��ͨ��2mol e- ʱ��X��Y�и���2molH+�����Ǩ�Ƶ��ұߣ�����C��ȷ��D����·�е��ӵ�����Ϊa![]() d��c
d��c![]() b��������װ���ڵ�H+�����Ǩ�Ƶ��ұ�һ���γɱպϻ�·������D��������ȷ��ΪD��
b��������װ���ڵ�H+�����Ǩ�Ƶ��ұ�һ���γɱպϻ�·������D��������ȷ��ΪD��

 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�