��Ŀ����
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�����ȷ������ָ�����ϳɰ���ӦN2+3H2![]() 2NH3��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
2NH3��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�����ɱ������ݿ�֪�÷�ӦΪ______��Ӧ������������������������
�������ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______________������ĸ�������
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����ӦCH4��g��+H2O��g�� ![]() CO��g��+3H2��g����ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g����ȡ����֪�÷�Ӧ�У�����ʼ������е�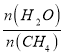 �㶨ʱ���¶ȡ�ѹǿ��ƽ��������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ��������CH4������Ӱ����ͼ��ʾ��

��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ��p1________p2������>��������������<������
�ڸ÷�ӦΪ________��Ӧ��������������������������
��3��ԭ����H2����ͨ����ӦCO��g��+H2O��g�� ![]() CO2��g��+H2��g����ȡ��T ��ʱ�����ݻ��̶�Ϊ2 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO2��Ũ��Ϊ0.3 mol��L��1����ƽ��ʱCO��ת����Ϊ________
CO2��g��+H2��g����ȡ��T ��ʱ�����ݻ��̶�Ϊ2 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO2��Ũ��Ϊ0.3 mol��L��1����ƽ��ʱCO��ת����Ϊ________
���𰸡� ���� ad < ���� 0.6
����������1�����ɱ������ݿ�֪�����¶����ߣ���Ӧ��ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ����������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��������
��a������ѹǿ��ƽ�������ƶ���H2ת��������a��ȷ��b��ʹ�ô�����ƽ�ⲻ�ƶ���H2ת���ʲ��䣬��b������c������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���H2ת���ʼ�С����c������d����ʱ����������е�NH3��ƽ�������ƶ���H2ת��������d��ȷ��
�ʴ�Ϊ��ad��
��2��������ӦΪ��������ķ�Ӧ������ѹǿƽ�������ƶ������麬������������P2>P1��
�ʴ�Ϊ��<��
����ͼ��֪�����¶�������ĺ�����С��˵�������¶�ƽ�������ƶ����������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��3����T��ʱ�����ݻ��̶�Ϊ2 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO2��Ũ��Ϊ0.3 mol��L��1����
CO(g) + H2O(g)CO2(g)+H2(g)
��ʼŨ��(mol/L):0.5 0.5 0 0
�仯Ũ��(mol/L):0.3 0.3 0.3 0.3
ƽ��Ũ��(mol/L):0.2 0.2 0.3 0.3
ƽ��ʱCO��ת����=![]() =60%��
=60%��
�ʴ�Ϊ��60%��0.6

 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д� С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д�
