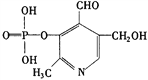
题目内容
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同质量不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6
D.同压强、同体积的N2O和CO2
【答案】AC
【解析】解:A、因N2和CO的摩尔质量均为28g/mol,则等质量时二者的物质的量相等,又都为双原子分子,则原子数相同,故A正确; B、由pV=nRT可知,同温度、同体积的H2和N2 , 压强与物质的量成正比,压强不确定,则物质的量不一定相等,故B错误;
C、同体积、同密度,则质量相同,C2H4中原子的物质的量为 ![]() ×6,C3H6中原子的物质的量为
×6,C3H6中原子的物质的量为 ![]() ×9,二者相等,故C正确;
×9,二者相等,故C正确;
D、由pV=nRT可知,同压强、同体积的N2O和CO2 , 温度与物质的量成反比,温度不确定,则物质的量不确定,故D错误;
故选AC.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
下列推断正确的是
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入盐酸, HCO3-比CO32-更易结合H+
D. 25℃时pH=9的CH3COONa和NaOH溶液,水电离出的c(H+)均为1×10-9mol·L-1
【题目】一定条件下,发生如下反应: A(s)+B(g)![]() C(s)+D(g)+E(g) △H<0,其中相对分子质量M(C)>M(A),起始时通入一定量的A 和B,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值。重新达到平衡后。纵坐标yY随X 变化趋势合理的是
C(s)+D(g)+E(g) △H<0,其中相对分子质量M(C)>M(A),起始时通入一定量的A 和B,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值。重新达到平衡后。纵坐标yY随X 变化趋势合理的是
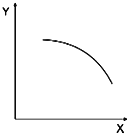
选项 | X | Y |
A | A的质量 | D的体积分数 |
B | B的物质的量 | B的转化率 |
C | B的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的平均摩尔质量 |
A. A B. B C. C D. D