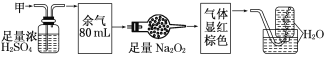
��Ŀ����
����Ŀ��һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ����; ����Co2O3 ��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С��ӷ����л���������(CoO)�Ĺ����������£�

��1������I�в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ ��
��2������II�м���ϡH2SO4�ữ���ټ���Na2S2O3��Һ������.������ܵ����ӷ�Ӧ����ʽΪ��������ֻ��һ������� ����ʵ����ģ�ҵ����ʱ��Ҳ������������ữ��Na2S2O3,��ʵ�ʹ�ҵ�����в������ᣬ��ӷ�Ӧԭ������������������ܵ���Ҫԭ�� ��
��3�������ӷ���ʽ��ʾ����III��IV��Na2CO3����Ҫ���� ��
��4��CoO��������ɵ÷ۺ�ɫ��CoCl2��Һ��CoCl2���ᾧˮ��Ŀ��ͬ�����ֲ�ͬ��ɫ��������ɫ����ˮCoCl2 ��ˮ��ɫ��һ���ʿ��Ƴɱ�ɫˮ�������īˮ.ͼ2�Ƿۺ�ɫ��CoCl2��6H2O�������ȷֽ�ʱ��ʣ������������¶ȱ仯�����ߣ�A���ʵĻ�ѧʽ�� ��

��5��ij��Ȼ��Ļ�ѧʽ�ɱ�ʾΪ2Na2CO3��NaHCO3��2H2O,ȡ��������������ˮ��ϡ��Һ�������йظ���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���� ������ţ���
A��c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B��c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C��3c(Na+)>5c(CO32-)+5c(HCO3-)
D��������Һ������NaOH��Һ�����c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
���𰸡���1��2Al��2OH����2H2O=2AlO2����3H2����
��2��4Co2O3��4CoO��S2O32����22H��=2SO42����12CO2����22H2O��Co2O3��CoO���������������������Ⱦ������
��3��2Al3����3CO32����3H2O=2Al(OH)3����3CO2����Co3����CO32��=CoCO3��
��4��CoCl2��2H2O����5��ACD��
��������
�����������1�������������Ʒ�����Ӧ�������������ӷ�Ӧ���̷�ʽ��2Al��2OH����2H2O=2AlO2����3H2������2����������ͼ��Co2O3������������Na2S2O3������Na2SO4�����ݻ��ϼ۵�����������ƽ�����ӷ�Ӧ����ʽΪ��4Co2O3��4CoO��S2O32����22H��=2SO42����12Co2����22H2O��Co2O3��CoO���������������������Ⱦ��������3����������ͼ��Al3����CO32������˫ˮ�ⷴӦ��2Al3����3CO32����3H2O=2Al(OH)3����3CO2������������ͼ��Co3����CO32��=CoCO3����4������ͼ��CoCl2��6H2Oȫ��ʧȥ�ᾧˮ�����ڵĹ�ϵ�ǣ�
CoCl2��6H2O��CoCl2��
238 130
m 65 ���m=119��
��Ӧ����ʽΪCoCl2��6H2O=CoCl2��(6��x)H2O��xH2O ��m��
238 18x
119 119��83
���x=4����ѧʽΪCoCl2��2H2O��
��5��A����ȻCO32����ˮ��̶ȴ���HCO3������ˮ��ij̶�����������Ȼ��ijɷ֣�c(CO32��) > c(HCO3��) >c(OH��)>c(H��)������ȷ��B�����������غ㣬Ӧ��3c(OH��)=2c(HCO3��)��5c(H2CO3)��3c(H��)��c(CO32��)���ʴ���C�����������غ㣺3c(Na��)=5[c(CO32��)��c(HCO3��)��c(H2CO3)]������ȷ��D�����ݵ���غ㣬c (Na��) +c (H��) =c (HCO3��) +2c (CO32��) +c (OH��)����ȷ��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�