题目内容
【题目】【化学——选修2:化学与技术】
元素铝是在生产、生活中应用广泛的金属元素。
(1)氧化铝是一种耐高温材料,也是工业上制取铝的原料。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下图所示:
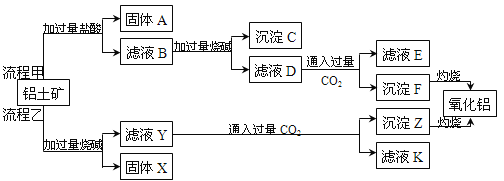
体A的主要成分是 (填化学式,下同),固体X的主要成分是 。
②滤液E中溶质的主要成分是 ,写出该溶质的一种用途: 。
③在滤液D中通入过量CO2时反应的离子方程式为 。
(2)工业上电解氧化铝冶炼铝时加入冰晶石(Na3AlF6)的作用是 。在电解池的工作过程中,需要不断补充阳极材料(石墨),原因是 。
(3)一种新型高效净水剂PAFC——聚合氯化铁铝[AlFe(OH)nCl6-n]m(n<5,m<10)可广泛应用于日常生活用水和工业污水的处理。下列有关PAFC的说法正确的是 (填序号)。
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同物质的量的氯化铝和氯化铁的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性或强碱性溶液中都能稳定存在
【答案】(1)①SiO2;Fe2O3、MgO;
②NaHCO3;制纯碱(或作发酵粉等合理答案);
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)作助熔剂(或降低氧化铝的熔点);电解时生成的O2在高温时会和石墨电极发生反应;
(3)BC。
【解析】
试题分析:(1)①铝土矿含有的成分中SiO2不与盐酸反应,所以固体A的主要成分是SiO2;Fe2O3、MgO不与NaOH溶液反应,所以固体X的主要成分是Fe2O3、MgO。②滤液D中主要含有NaAlO2,向其中通入过量CO2后,反应生成Al(OH)3和NaHCO3,Al(OH)3难溶于水,NaHCO3溶于水,所以滤液E中溶质的主要成分是NaHCO3,其可用来制纯碱或作发酵粉;③NaAlO2溶液通入过量CO2的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)氧化铝的熔点很高,电解时加入冰晶石的作用是作助熔剂,降低氧化铝的熔点。电解时生成的O2在高温时会和石墨电极发生反应,消耗石墨电极,故石墨电极需要不断补充。
(3)A.根据化合物中元素正负化合价代数和等于0,PAFC中铁元素显+3价,错误。氯化铝和氯化铁都能水解,溶液显酸性,PAFC是碱式盐,Fe3+、Al3+水解产生的H+可被溶液中的OH中和,对水的pH改变小,正确。C.PAFC可看作一定比例的氯化铁和氯化铝水解的中间产物,正确。D.PAFC既能与H+反应,又能与OH反应,在强酸或强碱性溶液中都不能稳定存在,错误。

 金博士一点全通系列答案
金博士一点全通系列答案