题目内容
8.(1)0.2mol CO(NH2)2(尿素)中含有0.8mol氢原子,所含氮元素的质量是5.6g,CO(NH2)2中四种原子的原子个数比C:H:O:N=1:4:1:2;(2)NA表示阿伏伽德罗常数的值,十水硫酸钠的化学式是Na2SO4•10H2O,在0.1mol十水硫酸钠中,①含有0.2NA个钠离子;②含有18g水.
(3)标准状况下,0.2mol SO2和32g CH4占有相同的体积.
分析 (1)结合m=nM及物质构成计算;
(2)1molNa2SO4•10H2O中含2mol钠离子,10mol水,结合N=nNA、m=nM计算;
(3)体积相同,则物质的量相同,结合n=$\frac{m}{M}$计算.
解答 解:(1)0.2mol CO(NH2)2(尿素)中含有0.2mol×4=0.8mol氢原子,所含氮元素的质量是0.2mol×2×14g/mol=5.6g,CO(NH2)2中四种原子的原子个数比C:H:O:N=1:4:1:2,故答案为:0.8;5.6;1:4:1:2;
(2)0.1mol十水硫酸钠中,①含有钠离子的个数为0.1mol×2×NA=0.2NA个;②含有水的质量为0.1mol×10×18g/mol=18g,故答案为:0.2NA;18;
(3)体积相同,则物质的量相同,甲烷的物质的量为$\frac{32g}{16g/mol}$=2mol,则二氧化硫的物质的量为0.2mol,故答案为:0.2.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成及物质的量为中心的计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的压强不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1mol X的同时生成0.2molZ |
16.少量的金属钠长期暴露在空气中,其最终产物不可能是( )
| A. | Na2CO3 | B. | Na2CO3•7H20 | C. | Na2O2 | D. | Na2CO3•10H20 |
3.室温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A. | 在NaNO3和NaCl混合溶液:H+、NH4+、SO42-、Cu2+ | |
| B. | 加入金属镁能产生H2的溶液:Na+、SO42-、Cu2+、NO3- | |
| C. | 常温下由水电离出的c(OH-)=10-12mol/L的溶液:Na+、SO32-、Cl-、Mg2+ | |
| D. | pH=2的溶液中:ClO-、K+、CH2CHO、SO42- |
13.对下列化学反应的分类正确的是( )
①硫在氧气中燃烧
②铝箔在氧气中燃烧
③蜡烛在氧气中燃烧
④双氧水与二氧化锰混合制氧气
⑤金属铁与盐酸反应制氢气
⑥石灰石与盐酸反应.
①硫在氧气中燃烧
②铝箔在氧气中燃烧
③蜡烛在氧气中燃烧
④双氧水与二氧化锰混合制氧气
⑤金属铁与盐酸反应制氢气
⑥石灰石与盐酸反应.
| A. | ①②③④属于氧化还原反应 | B. | ①②③属于化合反应 | ||
| C. | ①②③④③③六个反应中没有分解反应 | D. | ③③属于复分解反应 |
8.能制得括号中纯净物的是( )
| A. | 等物质的量的乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 氯气与乙烷在光照下反应(氯乙烷) | |
| C. | 苯与硝酸在浓硫酸、加热条件下反应(硝基苯) | |
| D. | 乙醇、乙酸与浓H2SO4混合加热(乙酸乙酯) |

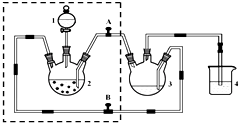 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: