题目内容
13.对下列化学反应的分类正确的是( )①硫在氧气中燃烧
②铝箔在氧气中燃烧
③蜡烛在氧气中燃烧
④双氧水与二氧化锰混合制氧气
⑤金属铁与盐酸反应制氢气
⑥石灰石与盐酸反应.
| A. | ①②③④属于氧化还原反应 | B. | ①②③属于化合反应 | ||
| C. | ①②③④③③六个反应中没有分解反应 | D. | ③③属于复分解反应 |
分析 有电子得失或偏移的反应为氧化还原反应;
两种或两种以上的物质生成一种物质的反应为化合反应;
一种物质生成两种或两种以上的物质的反应为分解反应;
一种单质和一种化合物生成另一种单质和另一种化合物的反应为置换反应;
两种化合物相互交换成分生成另外两种化合物的反应为复分解反应,据此分析.
解答 解:①硫在氧气中燃烧生成二氧化硫,是化合反应,也是氧化还原反应;
②铝箔在氧气中燃烧生成氧化铝,是化合反应,也是氧化还原反应;
③蜡烛在氧气中燃烧生成二氧化碳,是化合反应,也是氧化还原反应;
④双氧水与二氧化锰混合制氧气,二氧化锰做催化剂,是分解反应,也是氧化还原反应;
⑤金属铁与盐酸反应制氢气,是置换反应,也是氧化还原反应;
⑥石灰石与盐酸反应生成氯化钙和二氧化碳和水,是复分解反应,不是氧化还原反应.
A、属于氧化还原反应的是①②③④⑤,故A错误;
B、属于化合反应的是①②③,故B正确;
C、④是分解反应,故C错误;
D、③是化合反应,不是复分解,故D错误.
故选B.
点评 本题考查了常见反应类别的判断,应在会写反应的基础上根据四大基本反应类型和氧化还原反应的概念来分析判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列第三周期元素中,非金属性最弱的是( )
| A. | 硅 | B. | 氯 | C. | 磷 | D. | 硫 |
4.下列不属于配位化合物的是 ( )
| A. | 六氟合铝酸钠:Na3[AlF6] | B. | 氢氧化二氨合银:[Ag(NH3)2]OH | ||
| C. | 六氟合铁酸钾:K3[FeF6] | D. | 十二水硫酸铝钾:KAl(SO4)2•12H2O |
12.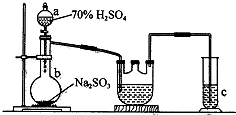 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
 Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O
Na2S2O4是重要的工业漂白剂,某化学小组欲制备Na2S2O4(如图)并探究其性质.现将1.5mol/L的HCOONa溶液和0.5mol/L NaOH溶液等体积注入三颈烧瓶,发生反应:HCOONa+2SO2+NaOH═Na2S2O4+CO2+H2O(l)a装置的名称:分液漏斗;c装置的目的吸收二氧化硫,防止污染空气.
(2)b中制SO2的化学方程式为-_Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑_;控制b中反应速率的方法是通过分液漏斗颈部活塞控制低价硫酸的快慢.
(3)当三颈烧瓶中溶液接近中性时停止通人气体,蒸发得到固体产品.取1.0g固体产品溶于5mL水中,加入1mL的银氨溶液,振荡,水浴10s出现银镶.
甲同学得出结论:10s时Na2S2O4银氨溶液反应形成银镜.
乙同学认为上述实验不能说甲的结论一定成立,其依据可能是因为HCOONa过量,分离出的晶体所含杂质HCOONa具有还原性也能发生银镜反应.
针对甲、乙同学的分歧,丙同学取该实验所得固体设计如下实验方案,请你帮助完成:
| 实验步骤 | 现象及结论 |
| 步骤Ⅰ:对三颈烧瓶分离出的产品进行重结晶得到纯净的Na2S2O4(仅需说明方法) | |
| 步骤Ⅱ:取0.1g步骤Ⅰ的产品溶于5mL银氨溶液,振荡,水浴加热10s,观察现象 | 若10S出现银镜,则甲的结论正确(或Na2S2O4具有还原性),反之则乙正确 |
13.下列说法正确的是( )
| A. | 13C和15N的质子数相差2 | B. | 18O的原子核内中子数为8 | ||
| C. | 12C和13C互为同位素 | D. | 1H2O和 2H2O互为同素异形体 |