题目内容
【题目】某化学兴趣小组同学设计如图装置:
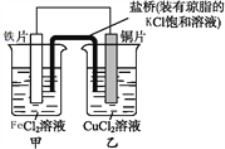
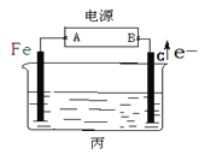
回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp(Fe(OH)3)=2.6×10-39,Ksp(Cu(OH)2)=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
【答案】正 Cu2++2e-=Cu 2.2×10-6 mol·L—1 负 有红色物质析出 4OH--4e-=O2↑+2H2O Fe 2Cl-+2H2O![]() H2+Cl2+2OH- 2.24 13
H2+Cl2+2OH- 2.24 13
【解析】
(1)装置甲乙构成原电池,铁片的活泼性大于铜片,铁片是负极,铜片是正极;
(2)根据Ksp【Fe(OH)3】计算溶液中c(OH-),再根据Ksp【Cu(OH)2】计算c(Cu2+)的最大值;
(3)丙是电解池,根据电子流动方向分析A极的名称;
(4)若丙池盛放足量的CuSO4溶液:①丙池铁棒是阴极,电极反应式为Cu2++2e-=Cu。②丙池碳棒是阳极,电极反应式为4OH--4e-=O2↑+2H2O ;
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L,
①丙池铁棒是阴极,电极反应式2H2O+2e-=H2↑+2OH-;丙池碳棒是阳极,电极反应式2Cl—-2e-=Cl2↑;
②25℃时,根据电极反应式,当丙池中有0.1mol电子发生转移时,阴极生成0.05mol氢气,阳极生成0.05mol氯气,此时溶液中c(OH-)=0.1mol/L。
(1)装置甲乙构成原电池,铁片的活泼性大于铜片,铁片是负极,铜片是正极;正极极反应式为Cu2++2e-=Cu;
故答案为:正;Cu2++2e-=Cu;
(2)根据Ksp【Fe(OH)3】=c(Fe3+)c3(OH-),c(OH-)=![]() =1×10-7mol/L,
=1×10-7mol/L,
Ksp【Cu(OH)2】= c(Cu2+)c2(OH-),c(Cu2+)= Ksp【Cu(OH)2】/ c2(OH-)=![]() =2.2×10-6mol/L;
=2.2×10-6mol/L;
故答案为:2.2×10-6 mol·L—1;
(3)丙是电解池,根据电子流动方向,A是负极;
故答案为:负极;
(4)若丙池盛放足量的CuSO4溶液:①丙池铁棒是阴极,电极反应式为Cu2++2e-=Cu,所以现象是有红色物质析出。②丙池碳棒是阳极,电极反应式为4OH--4e-=O2↑+2H2O ;
故答案为:有红色物质析出;4OH--4e-=O2↑+2H2O;
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L,
①丙池铁棒是阴极,电极反应式2H2O+2e-=H2↑+2OH-;丙池碳棒是阳极,电极反应式2Cl—-2e-=Cl2↑,丙池通电一段时间后,Fe极附近溶液呈红色,总反应的离子方程式:2Cl-+2H2O![]() H2+Cl2+2OH-;
H2+Cl2+2OH-;
②25℃时,根据电极反应式,当丙池中有0.1mol电子发生转移时,阴极生成0.05mol氢气,阳极生成0.05mol氯气,理论上标准状况下共有2.24L气体生成,此时溶液中c(OH-)=0.1mol/L,溶液的pH=13。
故答案为:Fe;2Cl-+2H2O![]() H2+Cl2+2OH- ;2.24;13。
H2+Cl2+2OH- ;2.24;13。

 名校课堂系列答案
名校课堂系列答案【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|