题目内容
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
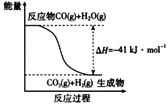
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g)![]() NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1(2a + 0.5b —0.5c)kJ·mol-1B
【解析】
(1)根据图像可知反应热=-41kJ/mol,所以反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;故答案为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1;
(2)反应热=反应物中键能之和-生成物中键能之和,则1/2N2(g)+3/2H2(g)===NH3(g)△H=0.5×948.9kJ/mol+1.5×436.0 kJ/mol-3×391.55 kJ/mol=-46.2 kJ/mol。故答案为:-46.2kJ·mol-1;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=akJmol-1;②2H2(g)+O2(g)=2H2O (l)△H2=bkJmol-1;③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=ckJmol-1;2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×1/2-③×1/2得到,所以反应焓变△H=2×a+b×1/2-c×1/2=(2a + 0.5b —0.5c)kJ·mol-1;故答案为:(2a + 0.5b —0.5c)kJ·mol-1;
(4)4Al(s)+3O2(g)═2Al2O3(s)△H1 ① 4Fe(s)+3O2(g)═2Fe2O3(s)△H2 ② 由盖斯定律①-②,得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2,则选B;故答案为:B。

 一线名师权威作业本系列答案
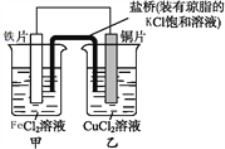
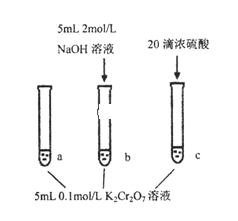
一线名师权威作业本系列答案【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度