��Ŀ����
����Ŀ�������ģ��������ʽṹ�й����ʺ��ص㣬�ش��������⣺
��1������Ԫ��Co ��̬ԭ�Ӽ۵��ӹ������ʽΪ_______________________________�����ĵ�����I4 (Co) < I4 (Fe) ����ԭ����__________________________________________��
��2�����Ȼ��������֣�PCl3��PCl5 ��PCl3����ԭ�ӵ��ӻ�����Ϊ__________��PCl3�����幹��Ϊ__________������PCl3�ķе�________������ڡ���С�ڡ���PCl5��ԭ����__________��
��3��̪ݼ�����л�����̪ݼ��������γɵĸ��ӷ��ӣ��ṹ��ʽ����ͼ��ʾ���÷����д��ڵĻ�ѧ��Ϊ___________����ѡ����ĸ��
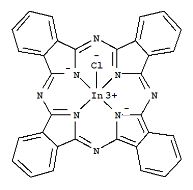
a���Ҽ� b���м� c�����Ӽ� d����λ��
��4�����ж��ֺ����ᣬ�����ƽ�ⳣ�����£�
��ѧʽ | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1��1010 | 1��10 | 1��102 | 4��108 |
�����ʽṹ�ĽǶȽ������Ϻ����� Ka ���μ�С��ԭ��________________________��
��5���ܵ�һ�ֻ�����ľ����ṹ����ͼ��ʾ��
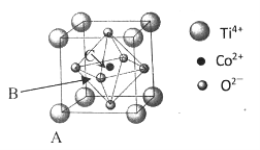
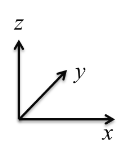
����֪A���ԭ���������Ϊ��0��0��0����C ��Ϊ��1/2��1/2��1/2������B���ԭ���������Ϊ___________��
����֪�������� a = 0.5485 nm����þ�����ܶ�Ϊ_______________g/cm3�����г��������ʽ���ɣ�
���𰸡�3d74S2���Ų�ͼ��ʧȥ���ǽ��ȶ���3d5�е�һ�����ӣ�Coʧȥ����3d6�е�һ������sp3������С�����Ȼ������Ȼ�����Һ̬ʱ�����ɷ�����ɵ����ʣ��������Ȼ��ķ��Ӽ��������ϴ����Ȼ��ķе�ϸ�abd���ǻ����������μ�С������ԭ�Ӽ�̬���μ�С��1/2,0,1/2 ��![]()
��������
(1)����Ԫ��Co Ϊ27��Ԫ�أ���̬ԭ�Ӽ۵��ӹ������ʽΪ3d74S2����һ����ʧȥ3�����ӣ�����ʧȥ���ȶ���3d5�е�һ�����ӣ�����Ҫ�ܴ����������Coʧȥ����3d6�е�һ�����ӣ����Ե�����ҪСЩ�������ĵ��ĵ����ܴ����ܵĵ��ĵ����ܡ�(2)���Ȼ�������ԭ�ӵļ۲���Ӷ���Ϊ3+��5-3��1��/2=4���ӻ���ʽΪsp3���ռ乹��Ϊ�����Ρ����Ȼ������Ȼ�����Һ̬ʱ�����ɷ�����ɵ����ʣ��������Ȼ��ķ��Ӽ��������ϴ����Ȼ��ķе�ϸߡ� (3) �л�����̪ݼ��������γɵĸ��ӷ����У������д���̼̼֮��Ķ��صĻ�ѧ�������ЦҼ��ͦм��������е�ԭ�Ӻͽ�����֮���γ���λ������ѡabd�� (4) HClO4 ��HClO3 ��HClO2��HClO������һ���ǻ�������ǻ�����ԭ�Ӹ����ֱ�Ϊ3��2��1��0�����ݵ���ƽ�ⳣ������ԭ�Ӹ����Ĺ�ϵ���������ǻ�������Խ�٣�����ƽ�ⳣ��ԽС�����������Ԫ����Ԫ�صĻ��ϼۣ��ֱ�Ϊ+7��+5��+3��+1������ԭ�Ӽ�̬ԽС������ƽ�ⳣ��ԽС������ԭ�Ӽ�̬���μ�С �� (5) ����֪A���ԭ���������Ϊ��0��0��0����C ��Ϊ��1/2��1/2��1/2����B��C���Ϊ���ģ���B����x��zϵ������C����ͬ��yϵ������Ϊ0����B���ԭ���������Ϊ��1/2,0,1/2 ��������������Ϊa=0.5485nm�������Ϊ��0.5485��10-7cm��3��Tiλ�ڶ��㣬����Ϊ8��1/8=1��Oλ�����ģ�����Ϊ6��1/2=3��Coλ�����ģ�����Ϊ1����ѧʽΪTiCoO3���þ�����ܶ�Ϊ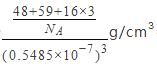 =
=![]() ��
��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�