题目内容
【题目】将一小块钠投入到盛有氯化镁溶液的试管里,不可能观察到的现象是 ( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
【答案】C
【解析】
钠投入到氯化镁溶液中,先与水反应生成氢氧化钠,出现与水反应的现象:熔成小球并在液面上游动,有气体生成;然后氢氧化钠与氯化镁发生复分解反应生成难溶物氢氧化镁沉淀,使溶液变浑浊,溶液底部不会有银白色物质镁生成,故选C。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】(题文)根据物质结构有关性质和特点,回答以下问题:
(1)过渡元素Co 基态原子价电子轨道表达式为_______________________________。第四电离能I4 (Co) < I4 (Fe) ,其原因是__________________________________________。
(2)磷的氯化物有两种:PCl3和PCl5 ,PCl3中磷原子的杂化类型为__________,PCl3的立体构型为__________,其中PCl3的沸点________(填“大于”或“小于”)PCl5,原因是__________。
(3)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图所示,该分子中存在的化学键为___________(填选项字母)
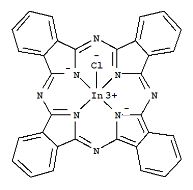
a.σ键 b.π键 c.离子键 d.配位键
(4)氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×10 | 1×102 | 4×108 |
从物质结构的角度解释以上含氧酸 Ka 依次减小的原因________________________。
(5)钴的一种化合物的晶胞结构如下图所示:
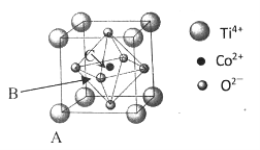
①已知A点的原子坐标参数为(0,0,0),C 点为(1/2,1/2,1/2),则B点的原子坐标参数为___________。
②已知晶胞参数 a = 0.5485 nm,则该晶体的密度为_______________g/cm3。(列出计算表达式即可)
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。

(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为_____________________(填化学式)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,写出其化学方程式____。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____________,N→⑥的单质的化学方程式为_____________。
