题目内容
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl。
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲烷(CH4是一种可燃物)燃料电池技术方面获得新突破。甲烷燃料电池的工作原理如下图所示:
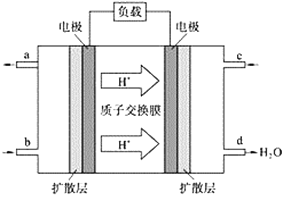
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式_________________________。
③工作一段时间后,当3.2 g甲烷完全反应生成CO2时,有__________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式:__________________________。
【答案】Ag—e-+Cl-=AgCl 正 2mol CH4 CH4—8e-+2H2O=CO2+8H+ 1.6 Ag2O+Zn+H2O=2Ag+Zn(OH)2
【解析】
(1)①负极上失电子发生氧化反应;②原电池放电时,电解质溶液中阳离子向正极移动;③根据Na2Mn5O10和转移电子之间的关系式计算;
(2)①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;③根据甲烷和转移电子之间的关系式计算;
(3)电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,据此分析书写电池反应方程式。
(1)①根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极反应式为:Ag+Cl--e-=AgCl,故答案为:Ag+Cl--e-=AgCl;
②在原电池中阴离子向负极移动,阳离子向正极移动,所以钠离子向正极移动,故答案为:正;
③根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,则外电路每通过4mol电子时,生成Na2Mn5O102mol,故答案为:2mol;
(2)①根据氢离子的移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料甲烷,故答案为:CH4;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:3O2+12H++12e-=6H2O,负极上甲烷失电子和水反应生成二氧化碳和氢离子,电极反应式为CH4—8e-+2H2O=CO2+8H+,故答案为:CH4—8e-+2H2O=CO2+8H+;
③3.2g甲烷的物质的量=![]() =0.2mol,根据CH4—8e-+2H2O=CO2+8H+知,转移电子的物质的量=0.2mol×8=1.6mol,则转移电子个数为1.6NA,故答案为:1.6;
=0.2mol,根据CH4—8e-+2H2O=CO2+8H+知,转移电子的物质的量=0.2mol×8=1.6mol,则转移电子个数为1.6NA,故答案为:1.6;
(3)电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,正极电极反应式为Ag2O+2e-+H2O═2Ag+2OH-,负极电极反应式为Zn-2e-+2OH-═Zn(OH)2,反应的总方程式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2,故答案为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。

 阅读快车系列答案
阅读快车系列答案【题目】(题文)根据物质结构有关性质和特点,回答以下问题:
(1)过渡元素Co 基态原子价电子轨道表达式为_______________________________。第四电离能I4 (Co) < I4 (Fe) ,其原因是__________________________________________。
(2)磷的氯化物有两种:PCl3和PCl5 ,PCl3中磷原子的杂化类型为__________,PCl3的立体构型为__________,其中PCl3的沸点________(填“大于”或“小于”)PCl5,原因是__________。
(3)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图所示,该分子中存在的化学键为___________(填选项字母)

a.σ键 b.π键 c.离子键 d.配位键
(4)氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×10 | 1×102 | 4×108 |
从物质结构的角度解释以上含氧酸 Ka 依次减小的原因________________________。
(5)钴的一种化合物的晶胞结构如下图所示:

①已知A点的原子坐标参数为(0,0,0),C 点为(1/2,1/2,1/2),则B点的原子坐标参数为___________。
②已知晶胞参数 a = 0.5485 nm,则该晶体的密度为_______________g/cm3。(列出计算表达式即可)
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为_____________________(填化学式)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,写出其化学方程式____。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____________,N→⑥的单质的化学方程式为_____________。