题目内容
研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______________L。
(2)已知:2SO2(g)+ O2 (g)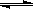 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 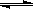 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 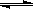 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 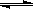 CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________________________。
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________________升。
(16分每空二分)(1)6.72 (2)-41.8;
(3)2CH3OH+3O2+4OH-=2CO32-+6H2O 负 下降 13.44
解析试题分析:(1)在反应6NO+8NH3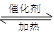 7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为
7N5+12 H2O中NO2作氧化剂,化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为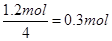 ,所以标准状况下的体积是
,所以标准状况下的体积是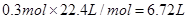 。
。
(2)根据热化学方程式① 2SO2(g)+O2(g) 2SO3(g) ΔH1=-196.6 kJ·mol-1 、② 2NO(g)+O2(g)
2SO3(g) ΔH1=-196.6 kJ·mol-1 、② 2NO(g)+O2(g) 2NO2(g) ΔH2=-113.0 kJ·mol-1可知,(②-①)÷2即得出NO2(g)+SO2(g)
2NO2(g) ΔH2=-113.0 kJ·mol-1可知,(②-①)÷2即得出NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=(ΔH2-ΔH1)÷2=(-113.0 kJ/mol+196.6 kJ/mol)÷2=+41.8kJ/mol。
SO3(g)+NO(g) ΔH=(ΔH2-ΔH1)÷2=(-113.0 kJ/mol+196.6 kJ/mol)÷2=+41.8kJ/mol。
(3)①由于电解质是强碱溶液,所以该甲醇燃料电池的总反应式是2CH3OH+3O2+4OH-=2CO32-+6H2O。
②原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以甲醇在负极通入。根据总反应式可知,电池在放电过程中溶液的pH将减小。16g甲醇的物质的量是16g÷32g/mol=0.5mol,在反应中失去0.5mol×6=3mol电子,则根据电子的得失守恒可知,生成氧气的物质的量是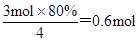 ,则氧气在标准状况下的体积是0.6mol×22.4L/mol=13.44L。
,则氧气在标准状况下的体积是0.6mol×22.4L/mol=13.44L。
考点:考查氧化还原反应的计算、盖斯定律的应用、原电池和电解池的有关判断与计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,旨在培养学生灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性,提高学生的应试能力和学习效率。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案(18分)为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为______________________。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)能说明氧化性Fe3+>SO2的离子方程式是______________________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq)
 FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: 能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论: 。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
| 实验编号 | 蒸馏水 | 淀粉溶液 | KI固体 | 稀KOH溶液 | 一段时间后观察实验现象 |
| 1 | 30mL | 2 mL | 5g | 0滴 | 试管中出现了蓝色 |
| 2 | 29.5 mL | | 5g | 10滴 | 试管中出现了很浅的淡蓝色 |
| 3 | 29 mL | 2 mL | | 20滴 | 试管中无明显变化 |
| 4 | | 2 mL | 5g | 30滴 | |
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4。
| 实验方案(不要求写具体过程) | 预期实验结果和结论 |
| | |
 ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。
ZrC+SiO2+2CO↑,该反应中氧化剂与还原剂的质量比为 。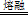 □Na2ZrO3+□CO2+□H2O
□Na2ZrO3+□CO2+□H2O
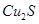 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(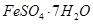 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下: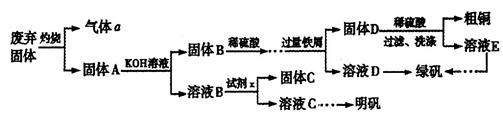

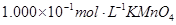 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO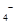 被还原为
被还原为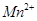 )。
)。