题目内容
某校研究小组为探究KI溶液的pH与其在空气之中氧化变质的关系,进行了相应的实验探究。
【提出假设】
假设1:只有碱性环境下能被氧化
假设2:只有酸性环境下能被氧化
假设3:只有中性环境下能被氧化
假设4: 能被氧化
【实验探究】
(1)有人认为由于I2会和KOH反应,因此否定假设1。小组同学认为,若溶液的碱性较弱时,I2不会反应。为了验证滚点,小组同学进行了下述实验:
在编号为①②③的试管中加入相同量的碘的淀粉溶液中,然后分别加入pH为9、10、11的KOH溶液,发现试管①中蓝色不消失,试管②③中蓝色消失。
由此可以得出结论: 。
(2)为探究KI溶液在不同碱性条件下能否被氧气氧化,小组同学设计了以下实验:将下表中的药品分别加入到试管中,然后放置于收集有氧气的储气瓶中,塞上塞子,观察现象。完成以下实验设计表(表中不要留空格)。
| 实验编号 | 蒸馏水 | 淀粉溶液 | KI固体 | 稀KOH溶液 | 一段时间后观察实验现象 |
| 1 | 30mL | 2 mL | 5g | 0滴 | 试管中出现了蓝色 |
| 2 | 29.5 mL | | 5g | 10滴 | 试管中出现了很浅的淡蓝色 |
| 3 | 29 mL | 2 mL | | 20滴 | 试管中无明显变化 |
| 4 | | 2 mL | 5g | 30滴 | |
注:1滴溶液体积为0.05mL。
(3)小组同学通过实验证实了在酸性条件下KI都能被氧气氧化,现继续探究酸性强弱与氧化难易的关系。有同学提出假设,认为酸性越强越容易被氧化。请设计实验验证假设,完成下表中内容。
可供选择的药品有:KI固体、淀粉溶液、0.005mol/L H2SO4、0.5mol/L H2SO4。
| 实验方案(不要求写具体过程) | 预期实验结果和结论 |
| | |
解析试题分析:结合题目前后的实验探究过程,可得出假设4为在一定pH范围内能被氧化。 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。 为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)。 对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。 铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有 海水的综合利用可以制备金属钠和镁等,其流程如下图所示: 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
假设4:在一定pH范围内(1分,合理表述均给分)
(1)碘单质只有在pH大于一定值时才能和碱性溶液反应(1分,合理表述均给分)
(2)实验编号 蒸馏水 淀粉溶液 KI固体 稀KOH溶液 一段时间后观察实验现象 1 2 2mL 3 5g [] 4 28.5 mL 试管中无明显变化
(3)实验方案(不要求写具体操作过程) 预期实验结果和结论 在编号为①②③的试管中分别加入0.005mol/L H2SO4、0.05mol/L H2SO4、0.5mol/L H2SO4各30mL,然后再向三只试管中
(1)实验现象说明碱性较弱时,碘单质不会和碱发生反应
(2)根据变量控制的思想,不难填充表格中的数据,第4组中KOH滴加得最多,碱性最强,可推知试管中也无明显变化。
考点:考查化学实验探究,实验设计知识。
万唯中考试题研究系列答案
1课3练世界图书出版公司系列答案
学生用书系列答案
全优训练系列答案
语文阅读阶梯训练系列答案
巴蜀英才课课练与单元测试系列答案
听力特训营系列答案
智慧万羽中考试题荟萃系列答案
新课标三维同步训练系列答案

(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
选用试剂
实验现象
方案1
方案2
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。 
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)A中发生反应的化学方程式为 。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(3)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性
Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。 过程Ⅳ B溶液中含有的离子 过程Ⅵ B溶液中含有的离子 甲 有Fe3+无Fe2+ 有SO42- 乙 既有Fe3+又有Fe2+ 有SO42- 丙 有Fe3+无Fe2+ 有Fe2+
(4)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: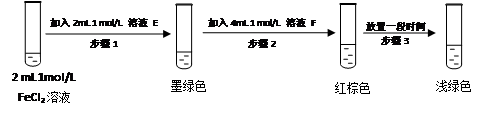
① 溶液E和F分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: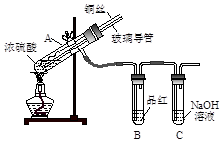

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。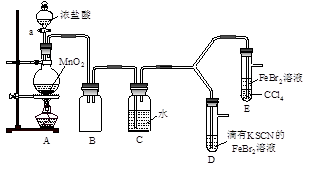
(5)根据下列实验操作和现象,填写实验结论。实验操作 实验现象 结论 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 D装置中:溶液变红
E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。
ⅲ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。 A.两性 B.良好导电性 C.熔点低 D.还原性,在反应中放出大量热 
下列说法不正确的是 ( )A.海水提盐都属于物理变化 B.利用母液可进一步提取溴,但要富集 C.上述流程中生成Mg(OH)2沉淀的离子方程式为:Mg2++Ca(OH)2= Mg(OH)2+Ca2+ D.不用电解MgO来制取镁是因为MgO熔点高,能耗大 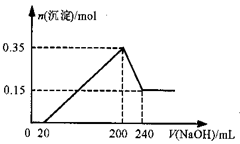
A.Mg和Al的总质量为8g B.硫酸的物质的量浓度为5 mol/L C.生成的H2在标准状况下的体积为11.2L D.NaOH溶液的物质的量浓度为5mol/L
 7N2+12H2O
7N2+12H2O  2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1