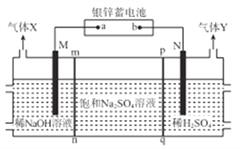
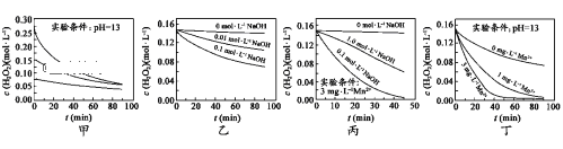
��Ŀ����
����Ŀ��(1)д��NaHSO4��ˮ�еĵ��뷽��ʽ________��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�Ҫ��ȥ��Щ���ʣ���ѡ�������Լ�����Na2CO3����NaOH����BaCl2����HCl �����Լ�������Ⱥ�˳����__________(�����)��
(3)2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O����˫���ŷ�����÷�Ӧ����ת�Ƶķ������Ŀ_______������0.1mol����ת��ʱ����Cl2�����Ϊ__________(��״��)����������HCl�����ʵ���Ϊ______________��
(4)ij��ɫ����Һ���ܺ���K+��Cu2+��Ca2+��SO42-��CO32-��Cl���еļ��֣��ֽ�������ʵ�飺
�ٵμ�BaCl2��Һ���а�ɫ�����������������˳���
�������������м���������ϡ���ᣬ�в��ֳ����ܽ⡣
������Һ����AgNO3��Һ���а�ɫ�������ɣ��ó���������ϡHNO3��
���жϣ�����Һ�п϶���__________���϶�û��_________��������_________�������ӷ��ţ���
���𰸡�NaHSO4=Na++H++SO42- �ڢۢ٢ܻ�ۢڢ٢ܻ�ۢ٢ڢ� 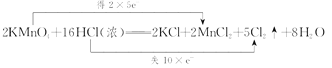 1.12L 0.1mol K+��SO42-��CO32- Cu2+��Ca2+ Cl-
1.12L 0.1mol K+��SO42-��CO32- Cu2+��Ca2+ Cl-
��������
(1)������NaHSO4��ˮ�еĵ��������������д���ӷ���ʽ��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�̼���Ƴ�ȥ�����ӡ��Ȼ�����ȥSO42-��NaOH��ȥþ���ӣ����������ȥ̼���ƣ�ע��̼����һ�����Ȼ���֮��
(3)2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ���+7�۽���Ϊ+2�ۣ�ClԪ�صĻ��ϼ���-1������Ϊ0����ϻ��ϼ۱仯����Ӧ���㣻
(4)��ɫ��Һ�в��������ɫ��Cu2+�����ɵij�������ϡ������ܽ⣬�����ΪBaSO4��BaCO3�Ļ���ԭ��Һ�к���SO42-��CO32-���������ӹ����֪��Һ�в������Ca2+������Һ����AgNO3��Һ���а�ɫ�������ɣ��ó���ΪAgCl�����ڢ��м���BaCl2��Һ��������Cl-�������ж�ԭ��Һ���Ƿ��������ӣ���������ҺΪ�����Կ�֪һ������K+���ݴ˽��н��
(1)NaHSO4��ˮ����ȫ�������Na+��H+��SO42-������NaHSO4��ˮ�еĵ��뷽��ʽΪ��NaHSO4=Na++H++SO42-��
(2)�����к�������CaCl2��MgCl2��һЩ�����Σ�Na2CO3��ȥCa2+��BaCl2��ȥSO42-��NaOH��ȥMg2+�����������ȥ����Ĺ�����NaOH��Na2CO3��Ϊ����ʵ��������裬Na2CO3һ����BaCl2��Һ֮����룬����Լ��ļ���˳�����Ϊ�ڢۢ٢ܻ�ۢڢ٢ܻ�ۢ٢ڢܣ�
(3)�ڷ�Ӧ2KMnO4+16HCl(Ũ) =2KCl+2MnCl2+5Cl2��+8H2O�У���Ԫ�ػ��ϼ۴ӷ�ӦǰKMnO4��+7�۽��͵���Ӧ��MnCl2�е�+2�ۣ���õ���5e-��ClԪ�صĻ��ϼ��ɷ�ӦǰHCl����-1������Ϊ��Ӧ��Cl2��0�ۣ�ʧȥ����2��e-�����ϼ���������С��������10e-����˫���ŷ���ʾΪ�� �����ݷ���ʽ��֪��ÿ��10mol����ת�ƣ���10molHCl����������Ӧ����5molCl2������0.10mol���ӷ���ת��ʱ����������HCl��0.1mol���������������ʵ�����0.05mol�����ڱ�״���µ����ΪV=0.05mol��22.4L/mol=1.12L��
�����ݷ���ʽ��֪��ÿ��10mol����ת�ƣ���10molHCl����������Ӧ����5molCl2������0.10mol���ӷ���ת��ʱ����������HCl��0.1mol���������������ʵ�����0.05mol�����ڱ�״���µ����ΪV=0.05mol��22.4L/mol=1.12L��
(4)��ɫ������Һ�в����ܴ�����ɫ��Cu2+���μ�BaCl2��Һ���а�ɫ�������������ɵij�������ΪBaSO4��BaCO3������BaCO3������ϡ���ᣬ�������˳��������ij����ɲ�������ϡ���ᣬ˵������SO42-��CO32-���ӡ�����SO42-��CO32-����Ca2+��Ӧ����CaSO4��CaCO3���������ܴ������棬��һ������Ca2+���ӣ�������Һ������ԭ��֪����Һ��һ������������K+���ӣ�����Һ�м���AgNO3��Һ���а�ɫ�������ɣ�����ΪAg2SO4��Ag2CO3��AgCl���������ڼ���BaCl2��Һ������Cl-�����Բ���ȷ���Ƿ���Cl-���ӡ����Ը�������������֪����Һ��һ�����е�����Ϊ��K+��SO42-��CO32-��һ������������Ϊ��Cu2+��Ca2+�����ܺ��е�����ΪCl-��

 Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д� ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д�����Ŀ��������������Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ���˸�����Դ�ṹ���������ŵȴ�ʩ����Ч����PM2.5��SO2��NOx����Ⱦ����ش��������⣺
(1)��һ������ijPM2.5��Ʒ������ˮ�ܽ��Ƴɴ�������(����OH��)�������²�ø���������ɼ���Ũ�����±������ݱ��������жϸ�������pH=___________��
���� | K�� | Na�� | NH4�� | SO42�� | NO3�� | Cl�� |
Ũ��(mol��L-1) | 4��10��6 | 6��10��6 | 2��10��5 | 4��10��5 | 3��10��5 | 2��10��5 |
(2)����β����NOx��CO�����ɣ�
��֪����������NO�ķ�ӦΪ��N2(g)+O2(g) ![]() 2NO(g) ��H>0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____��
2NO(g) ��H>0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____��
A�����������ܶȲ��ٱ仯 B����������ѹǿ���ٱ仯
C��N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D��������ת���ʲ��ٱ仯
(3)Ϊ����SO2���ŷţ���ϴ�Ӻ�SO2�����������п���Ϊϴ�Ӻ�SO2������ϴ�Ӽ��� ___________��
A��NaHCO3������Һ B��FeCl2������Һ C������CaCl2������Һ
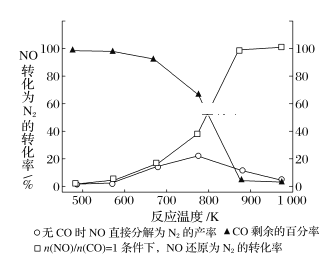
(4)����ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣ij�о���С����ʵ������Ag-ZSM-5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�����ͼ��ʾ������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ___________________________________����n(NO)/n(CO)=1�������£�Ϊ���õij�ȥNOx���ʣ�Ӧ���Ƶ�����¶���_____K���ҡ�
(5)�����ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿(����������)��һ����������������E��F�����¶ȷֱ���T1�� ��T2��ʱ����ø�����ƽ��ʱ���ʵ���(n/mol)���±���
���� �¶ȡ� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.100 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ____________________ (E,F���û�ѧʽ��ʾ)��
����T1<T2����÷�Ӧ�Ħ�H___________0��(�>����<����=��)
�ۼ���������ӦT1��ʱ��ƽ�ⳣ��K=__________________��