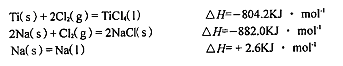题目内容
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应
2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应
有关物质产率与温度的关系如甲图。

(1)由反应①②可知反应⑤N2(g) + O2(g) 2NO(g)的反应热ΔH=
2NO(g)的反应热ΔH=
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为
① 4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应② 4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应
2N2(g)+6H2O(g) △H =" —1268" kJ/mol ②副反应有关物质产率与温度的关系如甲图。

(1)由反应①②可知反应⑤N2(g) + O2(g)
 2NO(g)的反应热ΔH=
2NO(g)的反应热ΔH= (2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为
(12分)(每空2分)
(1) +181.5 kJ/mol
(2) 780℃~840℃
(3) 抑制Fe3+的水解;Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
(4) 2NH3+ClO—=N2H4+Cl—+H2O
(5) 负极 2NH3—6e—+6OH—=N2+6H2O
(1) +181.5 kJ/mol
(2) 780℃~840℃
(3) 抑制Fe3+的水解;Fe3++3H2O
 Fe(OH)3+3H+
Fe(OH)3+3H+(4) 2NH3+ClO—=N2H4+Cl—+H2O
(5) 负极 2NH3—6e—+6OH—=N2+6H2O
试题分析:(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g)
 2NO(g),故△H=1/2×(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g)
2NO(g),故△H=1/2×(1)由盖斯定律,(①-②)×1/2可得N2(g)+O2(g) 2NO(g),故△H="+181.5" kJ·mol-1,
2NO(g),故△H="+181.5" kJ·mol-1,故答案为:+181.5 kJ·mol-1;
(2)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择780~840℃,
故答案为:780~840℃;
(3)溶液中铁离子水解Fe3++3H2O
 Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解,
Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解,故答案为:溶液中铁离子水解Fe3++3H2O
 Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解;
Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解;(4)NH3通入NaClO溶液中,生成N2H4,N元素的化合价升高,故Cl元素的化合价应降低,有氯离子生成,根据元素守恒与电荷守恒可知,还有水生成,配平后离子方程式为:2NH3+ClO-=N2H4+Cl-+H2O,
故答案为:2NH3+ClO-=N2H4+Cl-+H2O;
(5)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O.

练习册系列答案
相关题目
 CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。 CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:

 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1
 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是 SO2(g)+Q,Q值小于297.16 kJ
SO2(g)+Q,Q值小于297.16 kJ