题目内容
11.下列各离子加入强酸或强碱后,都能使其离子浓度降低的是( )| A. | Al3+ | B. | [Al(OH)4]- | C. | HCO3- | D. | SiO32- |
分析 A.Al3+与强酸不反应,与强碱反应;
B.[Al(OH)4]-与强酸反应,与强碱不反应;
C.HCO3-属于弱酸的酸式盐,与强酸、强碱都能反应;
D.SiO32-属于弱酸的酸根离子,与强酸反应,与强碱不反应.
解答 解:A.Al3+与碱反应,可以生成氢氧化铝沉淀或偏铝酸盐,但Al3+与酸不反应,故A错误;
B.[Al(OH)4]-与强酸反应,如与盐酸反应可以生成氯化铝与水,与强碱不反应,故B错误;
C.HCO3-属于弱酸的酸式盐,如与盐酸反应生成水与二氧化碳,与氢氧化钠反应生成碳酸钠与水,故C正确;
D.SiO32-可以与强酸反应,如与盐酸反应可以用生成硅酸沉淀,但SiO32-不强碱反应,故D错误;
故选C.
点评 本题考查了元素化合物的性质,掌握物质的性质是解本题的关键,侧重对基础知识的考查,难度不大,注意归纳总结中学常见的既能与酸反应又能与碱反应的物质.

练习册系列答案
相关题目
18.在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为( )
| A. | $\frac{n}{16}$ | B. | $\frac{n}{8}$ | C. | 4n | D. | 8n |
16.下列说法中,正确的是( )
| A. | 氯原子和氯离子的化学性质相同 | B. | 一价氯负离子比氯原子多一个电子 | ||
| C. | 氯气有毒,氯离子也有毒 | D. | 氯气和氯离子都显黄绿色 |
3.如图是氢氧燃料电池构造示意图.关于该电池说法中错误的是( )
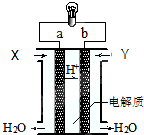

| A. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| B. | a极是负极 | |
| C. | 电子由a通过灯泡流向b | |
| D. | 通入的气体Y为O2 |
20.下列叙述错误的是( )
| A. | 合金材料中可能含有非金属元素 | |
| B. | 光导纤维的主要成分是二氧化硅 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
1.用N2和CO2 组成的混合气体,其相对于氢气的密度为18,则此混合气体中N2和CO2的物质的量之比为( )
| A. | 3:4 | B. | 1:2 | C. | 2:3 | D. | 1:1 |
 亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下: