题目内容
【题目】某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。装置气密性良好。

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学选用的装置_________(填序号)是没有必要的。实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则Na2CO4的质量分数为______(用含a、V、Vm的代数式表示)。
(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果有可能偏低,原因是________________。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用。按从左到右排列)_____________(填序号)。
【答案】③ ![]() 生成的二氧化碳的质量 CO2没有被装置②全部吸收 ⑩①③②⑨(或⑩①③⑨②)
生成的二氧化碳的质量 CO2没有被装置②全部吸收 ⑩①③②⑨(或⑩①③⑨②)
【解析】
(1)根据甲的实验原理可知,甲是想通过测量排出的水的体积来计算生成的氧气体积,进而来计算样品的纯度的,所以将氧气干燥是多余的。
答案选③;
实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则为氧气的总物质的量n(O2)=![]() mol,根据反应方程式2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O、2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
mol,根据反应方程式2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O、2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
假设氧气全由反应2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O所得,则Na2CO4的质量为![]() g,但还发生反应2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,则其中Na2O2的质量为
g,但还发生反应2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,则其中Na2O2的质量为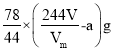 ,则Na2CO4的质量分数为
,则Na2CO4的质量分数为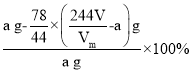 =
=![]() ;
;
(2)由乙的实验原理可知,乙是通过测量生成的二氧化碳的质量来测定其纯度的。如果反应中生成的CO2没有被装置②全部吸收,有可能使测定的结果偏低;
(3)要使结果更准确,就必须使反应中生成的二氧化碳完全被碱石灰吸收,而且还需要保证空气中的水和二氧化碳不参与反应,所以正确的顺序是⑩①③②⑨(或⑩①③⑨②)。