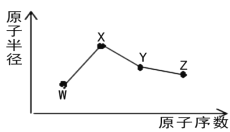
题目内容
【题目】常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
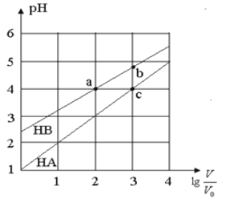
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当![]() =3时,若两溶液同时升高温度,则
=3时,若两溶液同时升高温度,则![]() 减小
减小
【答案】A
【解析】
试题分析:0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸。A.a点时,存在平衡:HBH++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(H+)=10-4mol/L,则Ka=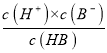 =
=![]() =1.11×10-5,故A正确;B.HA为强酸,NaA是强酸强碱盐不水解,溶液显中性,NaB为强碱弱酸盐,水解显碱性,所以相同条件下NaA溶液的pH小于NaB溶液的pH,故B错误;C.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=c<b,故C错误;D.升高温度促进弱酸的电离,所以HB中B-浓度增大,强酸的酸根离子浓度不变,所以A-的浓度不变,因此
=1.11×10-5,故A正确;B.HA为强酸,NaA是强酸强碱盐不水解,溶液显中性,NaB为强碱弱酸盐,水解显碱性,所以相同条件下NaA溶液的pH小于NaB溶液的pH,故B错误;C.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=c<b,故C错误;D.升高温度促进弱酸的电离,所以HB中B-浓度增大,强酸的酸根离子浓度不变,所以A-的浓度不变,因此![]() 增大,故D错误;故选A。
增大,故D错误;故选A。

练习册系列答案
相关题目