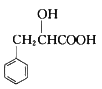
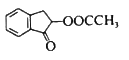
题目内容
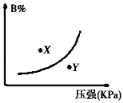
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
A. ①② B. ②④ C. ②③ D. ①③
【答案】C
【解析】
由图象可以看出,增大压强,B%增大,说明平衡向逆反应方向移动,则有n<p,注意A为固体的特征.在曲线上的点为平衡状态,图象中x和y没有达到平衡状态,根据B的含量判断反应趋向于平衡分析反应进行的方向,正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,据此解答。
①图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,A为固态,则有n<p,m+n与p关系不能确定,故错误;②x点位于曲线上方,未达到平衡状态,由图象可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即v正>v逆,故正确;③由图象可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点的反应速率慢,故正确;④由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,A为固态,则有n<p,故错误;所以正确的有②③;答案选C。

【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。
X | Y | ||||
Z | W | Q | |||
(1)Q的原子结构示意图是________。
(2)Y、Z、W形成简单离子,其离子半径关系为________(用离子符号表示)。
(3)用有关离子方程式表示Q、W元素的非金属性强弱______________
(4)Y的氢化物分子中含有18个电子,该分子中的共价键类型_____________________________。
(5)W的最高价氧化物对应的水化物的浓溶液与Cu反应的化学方程式为________________________。
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________,T1=_______;通过实验___________可探究出温度变化对化学反应速率的影响。
(2)C组实验中液褪色时间t1______(填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________。(用含有t1的式子表示)
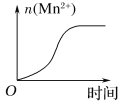
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________。