��Ŀ����
����Ŀ�������йص绯ѧװ�õ�������ȷ���� �� ��
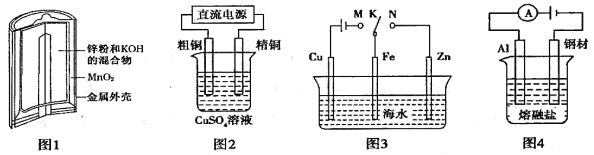
A��ͼ1�У�Zn��MnO2�ɵ�طŵ�ʱ��MnO2������
B��ͼ2�У���⾫��ͭʱ���������ٵ��������������ӵ�����һ�����
C��ͼ4�У��ڸֲ��ϵ��������������Al��ClԪ��ֻ��AlCl4����Al2Cl7����ʽ���ڣ���������ӦʽΪ��Al ��3e����7AlCl4��=== 4Al2Cl7��
D��ͼ3�У�K�ֱ���M��N���ӣ����ɱ���Fe�缫������Mʱ��Ϊ������������������������
���𰸡�C
��������
���������A��ͼ1��п�̵�أ�п��������ʧȥ���ӣ����ϼ����ߣ����������ʴ���B������ͭʱ����ͭ����������ͭ����������ͭ�к���������п������������ʧȥ���ӣ���Zn��2e��=Zn2����Fe��2e��=Fe2������ͭ�缫��ӦʽΪCu2����2e��=Cu�����ٵ�����������������ͬ���ʴ���C������װ��ͼ��������ӦʽΪAl��7AlCl4����3e��=4Al2Cl7��������ȷ��D������M��װ��Ϊ���أ�����������������������������������������������ָԭ���װ�ã��ʴ���

��ϰ��ϵ�д�
 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
�����Ŀ