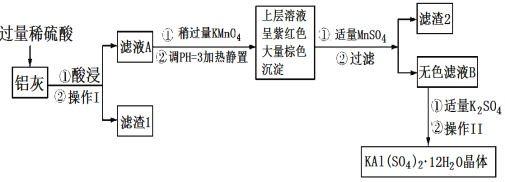
题目内容
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=__________;
NaHCO3+C6H5ONa的化学平衡常数K=__________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是_________(填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子浓度大小关系是________________,所得溶液中的物料守恒式为:________+________=__________=_________ molL-1,所得溶液中c(CH3COOH)=____________________molL-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______________,此时所得混合溶液的pH=_____。
【答案】2.14 CD b>a=d>c c(CH3COO-)>c(Na+)>c(H+)>c(OH-) c(CH3COO-) c(CH3COOH) 2c(Na+) 0.1molL-1 c(CH3COOH) = 0.05-10-4+10-10 1.8×10-7mol/L 2
【解析】
(1)根据反应的方程式结合平衡常数的含义和表达式计算;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,说明溶液显碱性,据此判断;
(3)根据电解质的强弱、溶液中氢离子或氢氧根离子的浓度结合溶液显中性判断消耗碱溶液的体积;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后醋酸过量,所得溶液的pH=4,说明醋酸的电离程度大于水解程度,据此解答;
(5)根据溶度积常数结合方程式计算。
(1)反应Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的离子反应方程式为CO32-+C6H5OH
NaHCO3+C6H5ONa的离子反应方程式为CO32-+C6H5OH![]() HCO3-+C6H5O-,化学平衡常数K=[c(C6H5O-)×c(HCO3-)]/[c(CO32-)×c(C6H5OH)]=[c(C6H5O-)×c(HCO3-)×c(H+)]/[c(CO32-)×c(C6H5OH)×c(H+)]=K(C6H5OH)/K(HCO3-)=(1.2×10-10)÷(5.6×10-11)=2.14;
HCO3-+C6H5O-,化学平衡常数K=[c(C6H5O-)×c(HCO3-)]/[c(CO32-)×c(C6H5OH)]=[c(C6H5O-)×c(HCO3-)×c(H+)]/[c(CO32-)×c(C6H5OH)×c(H+)]=K(C6H5OH)/K(HCO3-)=(1.2×10-10)÷(5.6×10-11)=2.14;
(2)溶液中的c(H+)=10-9molL-1,说明溶液呈碱性,则
A.CuSO4是强酸弱碱盐,铜离子水解溶液显酸性,A不符合;
B.HCl溶于水显酸性,B不符合;
C.Na2S是强碱弱酸盐,硫离子水解,溶液显碱性,C符合;
D.NaOH是一元强碱,其溶液显碱性,D符合;
E.K2SO4是强酸强碱盐,不水解,溶液显中性,E不符合;
答案选CD;
(3)①将pH=3的盐酸a L与浓度为1.0×10-3molL-1的氨水b L溶液混合恰好反应生成氯化铵溶液,铵根离子水解呈酸性,溶液呈中性需要氨水过量,b>a;
②将pH=3的盐酸a L与c(OH-)=1.0×10-3molL-1的氨水c L,等体积混合,平衡状态下的氢氧根和盐酸溶液中氢离子恰好反应,此时氨水电离平衡正向进行,氢氧根离子增大,若溶液呈中性,需要加入盐酸多,a>c;
③将pH=3的盐酸a L与c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L,等体积混合,氢离子和氢氧根恰好反应,溶液呈中性,a=d;
所以a、b、c、d之间由大到小的关系是得到b>a=d>c;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后醋酸过量,所得溶液是等浓度的醋酸钠和醋酸组成的混合溶液,溶液的pH=4,溶液显酸性,说明醋酸的电离程度大于水解程度,则所得溶液中各离子浓度大小关系是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),根据碳原子守恒可知所得溶液中的物料守式为c(CH3COO-)+c(CH3COOH)=2c(Na+)=0.1molL-1,则根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知所得溶液中c(CH3COOH)=2c(Na+)-c(CH3COO-)=c(Na+)+c(OH-)-c(H+)=(0.05+10-9-10-4)molL-1;
(5)向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,盐酸过量,根据方程式Ag++Cl-=AgCl↓可知反应后的c(Cl-)=(0.02mol/L×0.05L-0.018mol/L×0.05L)÷0.1L=0.001mol/L,则c(Ag+)=Ksp(AgCl)÷c(Cl-)=1.8×10-10/0.001 mol·L-1=1.8×10-7 mol/L,c(H+)=0.02mol/L×0.05L/0.1L=0.01mol/L,所以pH=2。