题目内容
【题目】银精矿(其化学成分有:Ag、Zn、Cu、Pb、S 及 SiO2 等)从其中提取银及铜和铅的工艺流程如图:

回答下列问题:
(1)“浸取”时,当盐酸的浓度和 KClO3 的量一定时,为提高浸取率可采取的措施是______(请用简练语言列举一项)。
(2)“分离Ⅰ”所加试剂 X 为______,“分离Ⅱ”所得滤渣中除含单质硫外,还含有的成分有______。
(3)“浸银”反应的化学方程式为______
(4)N2H4 的电子式为______,“还原”反应的离子方程式为______。
(5)“粗银”(含 Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是______(写出一条即可)。
(6)此类工厂排出的废水中含有 NO3-,对人体有害。科技人员在碱性条件下用 Al 粉将 NO3-还原为 N2。缺点是处理后的水中引入了 AlO2-,仍然对人体健康有害。
已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 Al(OH)3H+ + AlO2- + H2O K=1.0×10-13
①25℃时,欲将上述处理过水中的 AlO2- 浓度降到 1.0×10-6 mol/L,此时水中 c(Al3+)=______mol/L。
②25℃时,Al(OH)3 溶于 NaOH 溶液反应的平衡常数 K=______。
【答案】充分搅拌、粉碎银精矿、适当增大液固比、适当提高浸取温度、适当延长浸取时间 Zn SiO2 AgCl + 2Na2SO3 = Na3[Ag(SO3)2] + NaCl ![]() 4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O 防止生成的银被硝酸溶解;防止 NO3-优先于 Ag+在阴极放电 1.3×10-12 10
4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O 防止生成的银被硝酸溶解;防止 NO3-优先于 Ag+在阴极放电 1.3×10-12 10
【解析】
银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)加盐酸和氯酸钾浸取,过滤,溶液中含有Zn2+、Cu2+、Pb2+,滤渣中含有S、SiO2、AgCl等;浸出液中加金属还原剂Zn,把Cu2+、Pb2+还原为单质,则试剂X为Zn,分离得到Cu和Pb、ZnCl2溶液;浸出渣含有S、SiO2、AgCl,加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,过滤,滤渣为S和SiO2,滤液为Na3[Ag(SO3)2]和NaCl,在滤液中加N2H4,生成Ag和氮气;滤液中含有亚硫酸钠,氧化生成硫酸钠,以此解答该题。
(1)浸取时当盐酸的浓度和KClO3的量一定时,要加快化学反应速率的方法有:充分搅拌、粉碎银精矿、适当增大液固比、适当提高浸取温度、适当延长浸取时间,选择其中任意两种方法即可;
(2)分离得到氯化锌溶液可知加入的试剂X为Zn;根据分析可知“分离Ⅱ”所得滤渣中除含单质硫外,还含有SiO2;
(3)根据流程可知,浸银的反应物为AgCl和Na2SO3溶液,产物有Na3[Ag(SO3)2],根据元素守恒可知反应方程式为:AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl;
(4)N2H4 的电子式为![]() ;根据流程可知还原时主要反应物有Na3[Ag(SO3)2] 和N2H4,主要产物为氮气和Ag,可知反应过程银离子被还原,N2H4中氮元素被氧化,生成氮气,根据电子守恒和元素守恒可知离子方程式为:4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O;
;根据流程可知还原时主要反应物有Na3[Ag(SO3)2] 和N2H4,主要产物为氮气和Ag,可知反应过程银离子被还原,N2H4中氮元素被氧化,生成氮气,根据电子守恒和元素守恒可知离子方程式为:4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O;
(5)浓硝酸具有强氧化性能氧化Ag,生成硝酸银溶液,所以硝酸浓度不能过大,防止生成的银被硝酸溶解;同时溶液中有大量硝酸根离子,还要防止 NO3-优先于 Ag+在阴极放电;
(6))①水中AlO2-浓度降到1.0×10-6molL-1,依据Al(OH)3AlO2-+H++H2O,K=1.0×10-13,则c(H+)=![]() =10-7(mol/L),则c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]= c3(OH-)·c(Al3+)=1.3×10-33,则c(Al3+)=
=10-7(mol/L),则c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]= c3(OH-)·c(Al3+)=1.3×10-33,则c(Al3+)= =1.3×10-12molL-1;
=1.3×10-12molL-1;
②由①H2OOH-+H+、②Al(OH)3AlO2-+H++H2O 可知,②-①得到OH-+Al(OH)3AlO2-+H+,则Al(OH)3溶于NaOH溶液反应的平衡常数数值为K=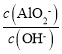 =
=![]() =10。
=10。

【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大