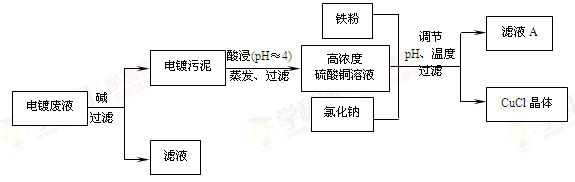
题目内容
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
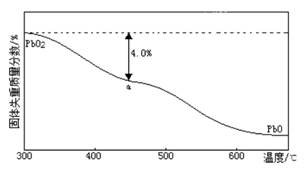
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。

(1)六 ⅣA 弱
(2)PbO2+4HCl(浓) △PbCl2+Cl2↑+2H2O
(3)PbO+ClO- PbO2+Cl- Pb2++2H2O—2e-
PbO2+Cl- Pb2++2H2O—2e- PbO2↓+4H+
PbO2↓+4H+
石墨上包上铜镀层 Pb2++2e- Pb↓ 不能有效利用Pb2+
Pb↓ 不能有效利用Pb2+
(4)根据PbO2△PbOx+(2—x/2)O2↑,有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
(2)PbO2+4HCl(浓) △PbCl2+Cl2↑+2H2O
(3)PbO+ClO-
 PbO2+Cl- Pb2++2H2O—2e-
PbO2+Cl- Pb2++2H2O—2e- PbO2↓+4H+
PbO2↓+4H+石墨上包上铜镀层 Pb2++2e-
 Pb↓ 不能有效利用Pb2+
Pb↓ 不能有效利用Pb2+(4)根据PbO2△PbOx+(2—x/2)O2↑,有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
试题分析:(1)根据题给信息知,铅是碳的同族元素,比碳多4个电子层,碳位于第二周期,则铅在元素周期表的位置为第六周期、第ⅣA族;根据同主族元素性质递变规律判断,PbO2的酸性比CO2的酸性弱。(2)根据题意知,PbO2与浓盐酸共热生成黄绿色气体氯气,迁移二氧化锰与浓盐酸的反应知,反应的化学方程式为PbO2+4HCl(浓) △PbCl2+Cl2↑+2H2O。(3)根据题给信息知,PbO与次氯酸钠溶液反应生成PbO2和氯化钠,反应的离子方程式为PbO+ClO-
 PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e-
PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e- PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e-
PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e- Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e-
Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e- Pb↓,这样做的主要缺点是不能有效利用Pb2+。(4)根据题给信息知,PbO2在加热过程发生的反应为PbO2△PbOx+(2—x/2)O2↑,则有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
Pb↓,这样做的主要缺点是不能有效利用Pb2+。(4)根据题给信息知,PbO2在加热过程发生的反应为PbO2△PbOx+(2—x/2)O2↑,则有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2 ·nPbO,2m+n/m+n=1.4,m:n=2/3。
练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
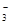 +6H2O+10e-=N2↑+12OH-
+6H2O+10e-=N2↑+12OH-