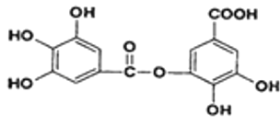
题目内容
【题目】漂白粉是常见的消毒剂,实验室可利用如图所示装置制取:
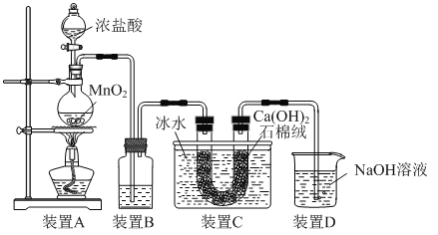
(1)装置A中所发生反应的化学方程式为_____。
(2)为除去挥发出的HCl,装置B中应装有_____。
(3)装置C中所发生反应的化学方程式为_____。
(4)装置D的作用是_____。
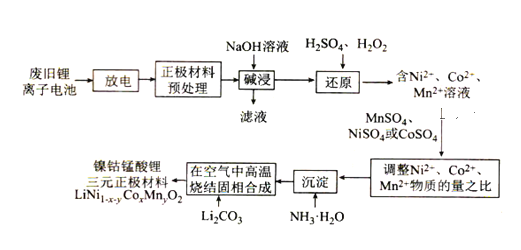
(5)有效氯含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量表示:Cl—+ClO—+2H+=Cl2+H2O[有效氯含量=![]() ×100%]。为测定装置C中所得漂白粉的有效氯含量,进行如下实验:准确称取装置C中所得漂白粉1.775g,将其与浓盐酸反应,所得Cl2在标准状况下的体积为0.112L。计算漂白粉的有效氯含量,并写出计算过程_____。
×100%]。为测定装置C中所得漂白粉的有效氯含量,进行如下实验:准确称取装置C中所得漂白粉1.775g,将其与浓盐酸反应,所得Cl2在标准状况下的体积为0.112L。计算漂白粉的有效氯含量,并写出计算过程_____。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+H2O 除去未被吸收的Cl2,防止污染空气 n(Cl2)=
MnCl2+Cl2↑+2H2O 饱和食盐水 2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+H2O 除去未被吸收的Cl2,防止污染空气 n(Cl2)=![]() =0.005mol,m(Cl2)=0.005mol×71g·mol=0.355g,有效氯含量=
=0.005mol,m(Cl2)=0.005mol×71g·mol=0.355g,有效氯含量=![]() ×100%=20%
×100%=20%
【解析】
二氧化锰和浓盐酸加热生成氯气,用饱和食盐水除去氯化氢,氯气通入氢氧化钙中反应生成次氯酸钙、氯化钙,最后用氢氧化钠溶液吸收尾气。
(1)装置A中二氧化锰和浓盐酸加热生成氯气,发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2) 用饱和食盐水除去氯化氢,为除去挥发出的HCl,装置B中应装有饱和食盐水;
(3)装置C中氯气和氢氧化钙反应生成次氯酸钙、氯化钙、水,发生反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+H2O;
(4) 装置D中氯气和氢氧化钠反应生成氯化钠、次氯酸钠,装置D的作用是除去未被吸收的Cl2,防止污染空气;
(5) n(Cl2)=![]() =0.005mol,m(Cl2)=0.005mol×71g·mol=0.355g,有效氯含量=
=0.005mol,m(Cl2)=0.005mol×71g·mol=0.355g,有效氯含量=![]() ×100%=20%;
×100%=20%;

 名校课堂系列答案
名校课堂系列答案【题目】下表中各组物质之间不能通过一步反应实现如图的是( )
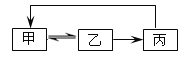
甲 | 乙 | 丙 | |
A | NaHCO3 | Na2CO3 | NaCl |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |
A.AB.BC.CD.D
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
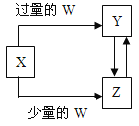
选项 | W | X |
A | 盐酸 | Na2CO3溶液 |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | NaOH | AlCl3溶液 |
A.AB.BC.CD.D
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D